奈良先端科學技術大學院大學先端科學技術研究科的廣田俊教授和酒井隆裕(研究生)的研究團隊,與筑波大學計算科學研究中心、大分大學研究管理機構、兵庫縣立大學研究生院理學研究科共同宣佈,在針對免疫反應中識別病原體等異物並進行攻擊的抗體研究中,發現了一種抗體之間以新模式結合(締合)的締合體。通過管柱層析術和X射線晶體結構分析發現,4個抗體結合成四締合體與單體呈平衡狀態存在。該發現有望為新藥開發做出貢獻。該研究成果已於12月8日刊登在國際學術期刊《Nature Communications》上。
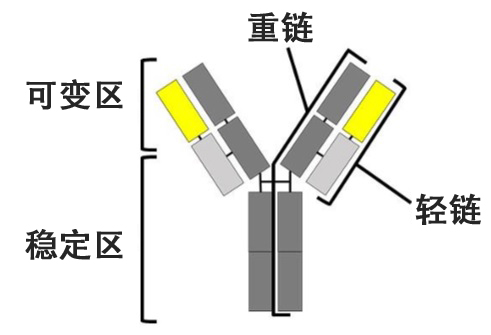
圖1.抗體結合模式圖(供圖:奈良先端科學技術大學院大學)
抗體依靠長短兩條蛋白質(免疫球蛋白)結合,在「Y字」型的上部(變異區)識別抗原。輕鏈位於Y形上側,其中有變異區和穩定區。利用抗體的抗體藥物因具有高療效和低對作用的特點而受到關注。
然而抗體容易凝集,一旦凝集識別抗原的能力就會受損,凝集體的沉積物會對機體造成危害。特別是以錯誤構造摺疊的抗體輕鏈更容易凝集,進一步導致凝集化和沉積物,有可能引起澱粉樣變性,從而導致器官功能障礙。
另一方面,抗體凝集體在原子水平上的構造尚不清楚。如果能夠特定抗體輕鏈的締合狀態,就有可能得到對提高質量有幫助的知識。
為此,研究人員採用管柱層析術這一分析蛋白質大小的方法和X射線晶體結構分析進行研究,並發現了在締合和解離之間取得平衡的抗體輕鏈。
此外,研究人員還成功地結晶出了四締合體樣品,並使用大型同步輻射設施SPring-8的X射線在原子水平上確定了其分子結構。結果表明,變異區通過分子間交換一部分相同空間結構的現象——三維結構域交換(3D domain swapping)而締合,形成二締合體,該二締合體進一步二締合化後形成四締合體。
在三維結構域交換後的二締合體之間的相輔作用界面上,存在很多疏水性胺基酸殘基,這些殘基的疏水性相輔作用,阻止了水分子的影響,使四締合體呈現穩定化。
此次發現的新的締合狀態被認為能有效穩定抗體,有利於開發設計出更易處理的新型抗體藥物。
廣田教授表示:「近年來,抗體作為藥品備受關注,但凝集導致不能使用成了一大問題。而且‘凝集’有各種各樣的形式,原子水平上抗體的凝集機制幾乎是未知的。通過此次的研究成果,我們瞭解到三維結構域交換這一現象在抗原識別部位發生,從而提高了穩定性。期望這些資訊有助於未來抗體藥物的開發」。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:《Nature Communications》
論文:Structural and Thermodynamic Insights into Antibody Light Chain Tetramer Formation through 3D Domain Swapping
URL:www.nature.com/articles/s41467-023-43443-4













