神戶醫療產業都市推進機構尖端醫療研究中心腦循環代謝研究部部長田口明彥等的研究團隊與德國弗勞恩霍夫研究所、英國華威大學、日本島根大學等共同提示了阿茲海默症的新治療靶點,提出了激活海馬神經再生的新機制。該成果有望促進癡呆症治療方法的開發和抗老化領域的發展。相關成果刊登於國際學術雜誌《Neuroprotection》11月21日號上。
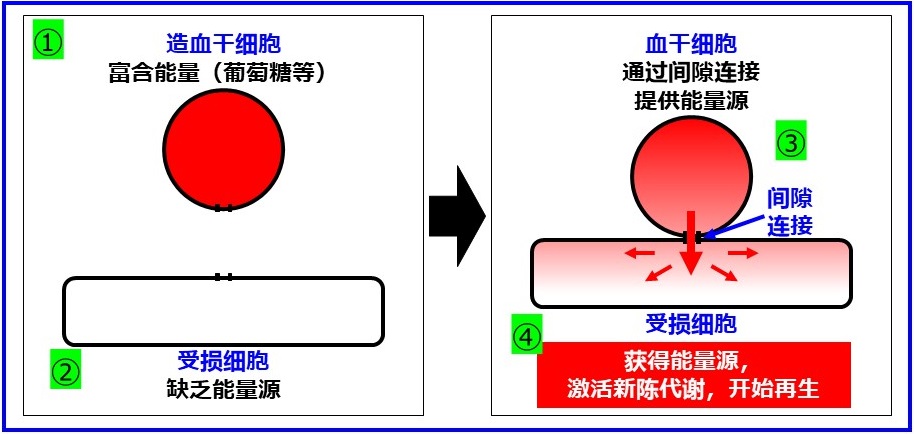
圖 新提出的癡呆症發病和老化機制模式圖(供圖:神戶醫療產業都市推進機構)
迄今為止,有關癡呆症的發病和老化的本質,研究人員提出的機制存在明顯的矛盾,為此研究團隊猜測阿茲海默症的發病和人老化的原因可能是因為能量產生量的減少。
由於造血幹細胞有望治療癡呆症和促進年輕化,並且因老化導致的外周血中造血幹細胞數量的下降很可能與腦功能下降和癡呆症發病有關,因此研究團隊此次重點研究了與能量產生量的關係。
澱粉樣蛋白清除藥物(侖卡奈單抗等)的臨床試驗結果表明,雖然清除澱粉樣蛋白可以稍微減緩認知功能障礙的惡化,但清除澱粉樣蛋白後,惡化仍然持續。
傳統的病理機制認為,癡呆症是由於澱粉樣蛋白和tau蛋白等有害物質的積累,導致大腦功能障礙而引起的。另一方面,即使清除了有害物質之後症狀也會惡化,因此原本被認為是原因的有害物質的積累很有可能只是一個病情導致的結果。
此外,給老化小鼠注射造血幹細胞可以增加海馬新生神經元的數量並改善認知功能(新記憶能力),外周血中造血幹細胞數量少的患者認知功能較差,以及癡呆症患者的海馬新生神經元出現急劇減少,研究人員認為癡呆症的確切治療靶點是海馬新生神經元的激活。
根據新的機制,(1)完全維持細胞和組織的功能需要大量的能量,但能量產生量會隨著年齡的增長而減少;(2)當能量產生量的儲備能力為零時,完全維持功能的時期便宣告結束,人開始老化;(3)之後,隨著產生能量不足的進一步加劇,機體越來越無法清除澱粉樣蛋白和tau蛋白等有害物質,也無法修復粒線體和DNA傷害,從而導致老化和功能障礙的發生與進展。
根據新的機制,癡呆症發病和老化分別是由可以完全維持大腦和身體功能的期間結束而引起的,並由此導致澱粉樣蛋白和tau蛋白等有害物質產生積累以及粒線體和DNA等傷害的積累。
老化和再生儘管方向性相反,但基本機制是共通的。「能量產生量隨年齡增長而減少的機制」和「通過再生醫學增加能量產生量的機制」有許多共通之處。
這一機制也可以解釋異種共生(parabiosis,比如通過手術將兩隻動物連接在一起,製造出共享血液、血管和心臟等循環系統的狀態)的返老還童機制。
田口部長表示:「這簡直就是老化研究領域的哥倫布之卵!在科學領域,有時僅僅是簡單地變換一下思維,可能就會帶來飛躍性的進展。本次,因這種思維方式的轉變,不僅推動了老化機制的本質闡明,還在明確的科學基礎之上開始了抗老化治療的開發。不僅限於醫學界,我們也十分歡迎與物理可用能、化學、社會科學等多個領域的研究人員進行合作研究。如有意向請與我聯繫。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Neuroprotection
論文:Activation of neurogenesis in the hippocampus is a novel therapeutic target for Alzheimer’s disease
DOI:10.1002/nep3.25













