東京大學研究生院農學生命科學研究科的喜田聰教授和日本國立精神與神經醫療研究中心精神保健研究所的金吉晴所長、堀弘明室長等人組成的研究團隊發表研究成果稱,明確了創傷後壓力障礙(PTSD)的分子機制。該研究對PTSD患者的外周血和PTSD模型小鼠的海馬區基因表現進行了全面比較,發現兩者均出現了cAMP信號傳遞途徑的負調控因子——磷酸二酯酶4B(PDE4B)的表達下降現象。研究還證實,患者體內該因子的表達量越低,再體驗症狀越嚴重,而模型小鼠則會因為cAMP信號傳遞途徑的活化而強化創傷記憶。該研究有望為開發PTSD的診斷和治療方法等提供幫助。相關研究成果已於2月27日發表在國際學術期刊《Molecular Psychiatry》上。
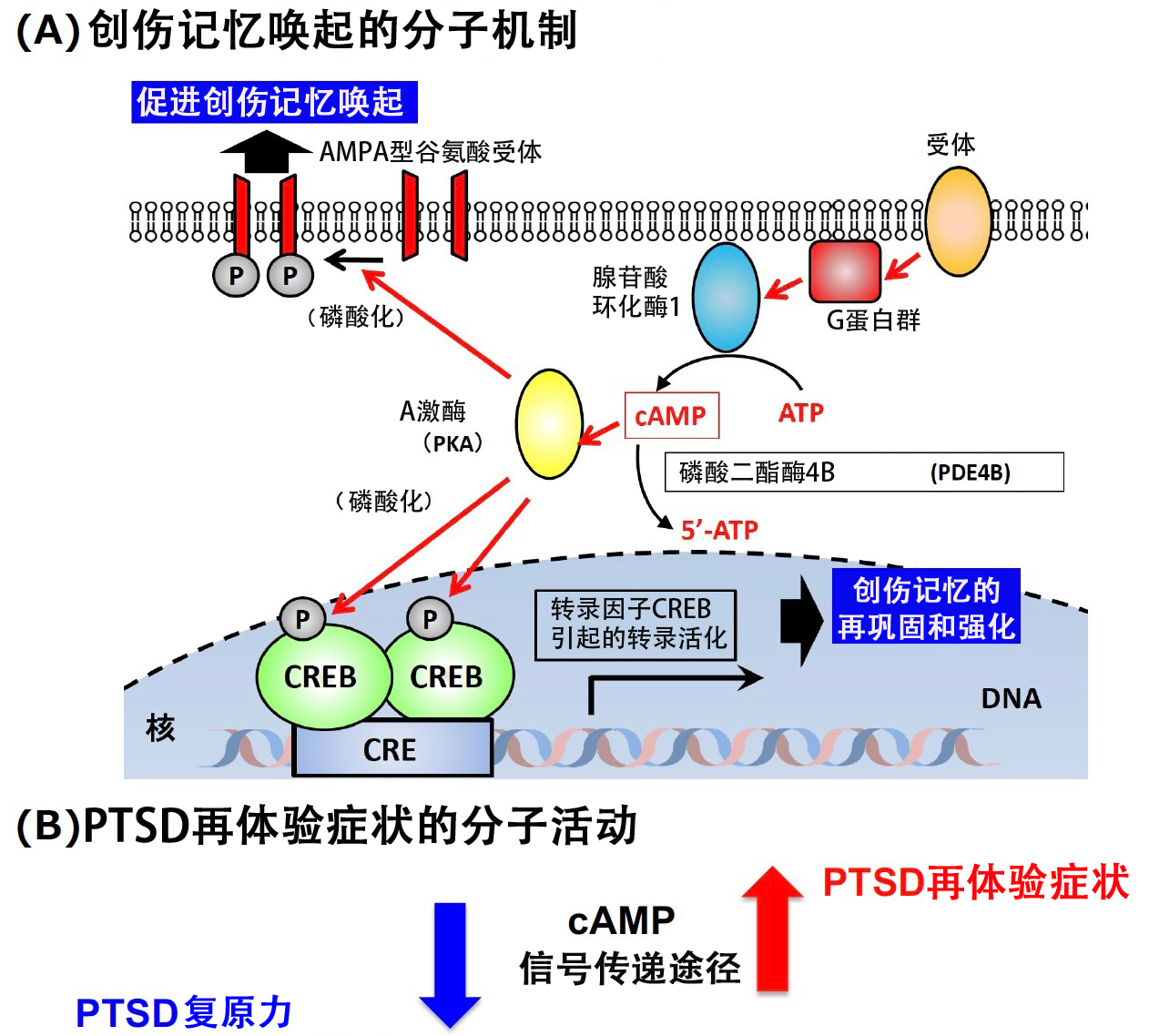
圖1:本研究中提出的PTSD再體驗症狀的分子機制(供圖:東京大學)
(A)基於迄今為止的研究成果(長谷川等,Nat Commun., 2019)和本研究成果的創傷記憶喚起的分子機制
(B)cAMP信號傳遞途徑的過度活化引發的PTSD再體驗症狀發作
PTSD是一種在經歷了生死攸關的創傷體驗後發作的精神病疾患,主要症狀包括再體驗症狀(閃回:創傷記憶喚起的症狀)和迴避、過度覺醒等,其中再體驗症狀作為PTSD特有的症狀而為人所知。
近年來,利用創傷體驗的代表例子——恐懼記憶在動物中普遍存在這一點,把以齧齒動物為中心開展的恐懼記憶相關研究成果應用於PTSD治療的研究正在不斷推進。然而由於PTSD的發病機製不明,目前尚無治療藥物,醫生只能開出緩解症狀的藥物。
此次研究團隊為了揭示PTSD的分子機制,特別針對具有強烈再體驗症狀的PTSD患者和PTSD模型小鼠海馬區恐懼記憶喚起時的mRNA表達進行了全面比較。PTSD模型小鼠通過恐懼情境條件學習,形成了將其置於箱子中便會喚起恐懼(創傷)記憶並表現出恐懼反應(無法移動)的條件性恐懼。恐懼反應的程度用5分鐘内恐懼反應的持續時間來評價。
研究人員對患者與模型小鼠兩者體內相對於健康狀態而言表達量發生變化的遺傳基因進行搜尋後,發現PDE4B的表達出現降低。該基因負責編碼分解cAMP的酶,其表達下調意味著cAMP信號傳遞途徑的活化。
此外,研究人員還調查了患者外周血的mRNA表達水平與再體驗症狀嚴重程度之間的關係,結果發現mRNA的表達水平越高,再體驗症狀的嚴重程度就越嚴重。同時,研究還表明患者外周血PDE4B基因的甲基化與mRNA表達水平存在相關,而且表達降低可以是持續性的。當模型小鼠的恐懼記憶被喚起時,不僅海馬區,外周血中的PDE4BmRNA的表達量也降低了。這一結果證實,患者和模型小鼠間具有高度同源性。
接著,研究人員對恐懼記憶與cAMP信號傳遞途徑活化的關聯進行了驗證。此前,該研究團隊已經成功揭示了cAMP對記憶的鞏固和喚起等方面的重要性。
利用光遺傳學方法,研究人員在小鼠大腦中構建了一個通過光照人為增加cAMP數量的試驗系統,並以此研究了cAMP增加對恐懼記憶的影響。
結果顯示,增加了cAMP的小鼠在恐懼記憶喚起時,恐懼反應變強。並且,如果24小時後再次喚起恐懼記憶,即使不增加cAMP,恐懼反應也會變得更強烈,導致病情加重。實驗中還觀察到了類似再體驗症狀的行為。
反之,研究人員構建了一個增加PDE4B降低cAMP的試驗系統,結果發現恐懼反應降低,恐懼記憶的再鞏固也被抑制。在恐懼記憶喚起前,研究人員將研究團隊開發的藥物NB001——一種作為慢性疼痛治療藥物而開發的(正在進行臨床試驗)降低cAMP的藥物投用給模型小鼠,也得到了同樣的結果。
這些結果表明,cAMP的過度活化是PTSD再體驗症狀加重的分子活動。
為診斷和治療方法的開發鋪平道路
喜田教授表示:「通過該研究,我們揭示了PTSD的分子活動,為開發以信號傳遞系統為靶點的PTSD診斷和治療方法開闢了道路。影響cAMP信號傳遞途徑的基因非常多,引起該信號傳遞系統過度活化的基因也多種多樣,可以推測與PTSD相關的基因突變也存在多樣化的可能性。這些情況可能是迄今為止PTSD的致病基因沒有固定在一個基因上的原因。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Molecular Psychiatry
論文:Fear memory regulation by the cAMP signaling pathway as an index of reexperiencing symptoms in posttraumatic stress disorder
DOI:10.1038/s41380-024-02453-4













