東京大學研究生院理學系研究科的鹽井琢郎(研究生)和東京大學定量生命科學研究所的胡桃坂仁志教授等組成的研究團隊發表研究成果稱,成功明確了DNA修復蛋白「RAD51」修復染色體上DNA雙鏈斷裂的機制。研究人員通過使用冷凍電子顯微鏡分析試管中人類RAD51修復DNA雙鏈斷裂過程中的復合體構造,取得了這一重要成果。研究結果顯示,RAD51的胺基末端結構域(N末端結構域)會與核小體結合,在剝離纏繞在核小體上的DNA的同時進行修復。N末端結構域的突變在許多癌症患者體內都有發現,這一研究成果有望為闡明該突變導致的癌症發病機製開闢道路。相關研究成果已於4月4日發表在國際學術期刊《Nature》上。
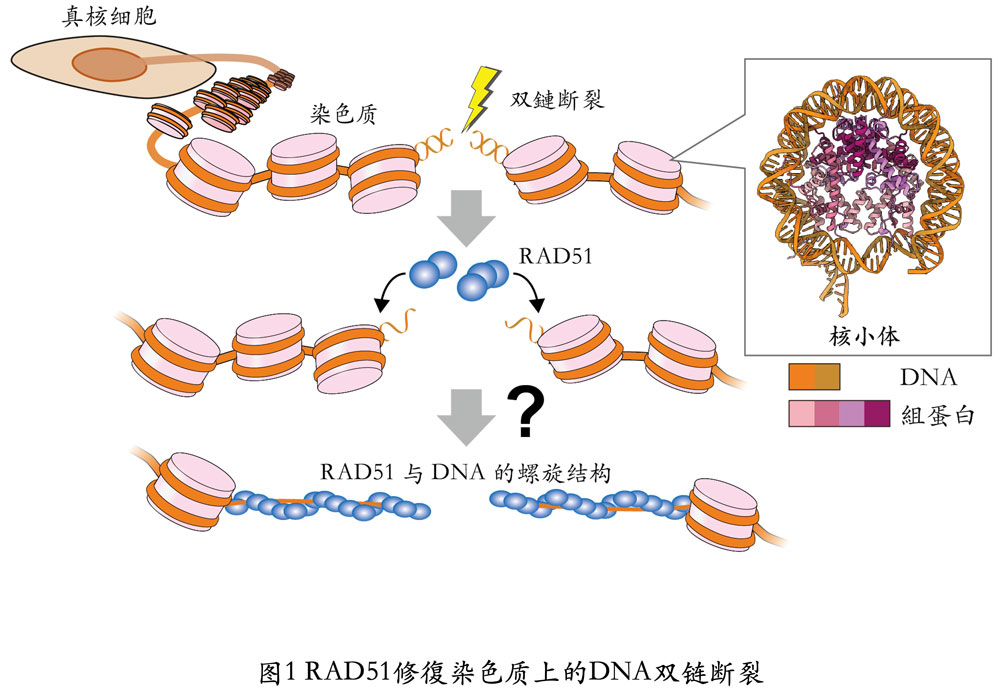
包含人類在内的真核生物所擁有的基因體DNA,會形成以核小體為基礎單位的染色質。基因體DNA上發生DNA雙鏈斷裂後,RAD51收歛集在DNA上進行修復。(提供:東京大學)
基因體DNA經常會受到紫外線等因素的傷害,尤其是輻射等引起的雙鏈斷裂,這種傷害是誘發癌症的原因之一。已知負責這類修復的是DNA修復蛋白「RAD51」。
然而,在包括人類在内的真核生物的染色體上,基因體DNA有著緊密摺疊的染色質結構,RAD51是如何在這種狀態下進行修復的此前一直不清楚。
在真核生物染色體中,基因體DNA牢固纏繞在組蛋白復合體上形成核小體,這些核小體相互連接形成了染色質構造。
此次,研究團隊在試管内再現了基因體DNA雙鏈斷裂的修復反應,並用冷凍電子顯微鏡進行了觀察。研究人員獲得了大量封裝在非晶冰中的反應中間體圖像,並通過疊加同方向的圖像提高了解析度,獲得了二維平均圖像,進而重建了三維構造。
由此,研究人員成功解析了RAD51修復雙鏈斷裂的過程。
首先,研究人員通過觀察,確認了RAD51形成由八聚體~十聚體組成的環狀結構,並與核小體結合的情況。進一步又發現RAD51將斷裂位點結合到活性中心以形成絲狀結構,在核小體上剝離DNA的同時通過形成螺旋結構與核小體相結合。研究還發現,RAD51的環狀結構能夠以雙鏈斷裂修復的活性中心——L1環區為媒介,識別雙鏈的斷裂位點。
研究人員還獲得了RAD51在沒有斷裂位點的核小體上形成循環結構的圖像。這些RAD51被認為將負責傷害初期階段的修復。
此外,研究還發現,一直以來功能不明的RAD51胺基末端結構域(N末端結構域)對於與核小體的結合至關重要。
N末端結構域在沒有染色質結構但能修復雙鏈的細菌攜帶RAD51同源性體(RecA)中並不存在。這表明N末端結構域是真核生物在演化過程中獲得的。
此前的研究證實,N末端結構域的突變在許多癌症患者體內都有發現,而此次研究結果表明,這些患者的癌症發病原因,可能是由於RAD51突變導致N末端結構域無法與核小體結合,從而導致斷裂的雙鏈未能得到妥善修復的緣故。
研究團隊未來將繼續深入研究,以便進一步明確RAD51是以怎樣的機制發現需要修復的斷裂位點的。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Nature
論文:Cryo-EM structures of RAD51 assembled on nucleosomes containing a DSB site
DOI:10.1038/s41586-024-07196-4













