日本和歌山縣立醫科大學醫學部尖端醫學研究所生體校正元件研究部的佐佐木泉講師和改正恆康教授等帶領的研究團隊發表研究成果稱,利用小鼠揭示了內質網壓力感測器IRE1α通過發炎小體誘導產生發炎細胞介素IL-1β的機制。研究團隊通過向小鼠腹腔注射霍亂毒素分析了基因表現。通過調查小鼠對霍亂毒素的反應發現,霍亂毒素作用於腹腔内的常駐巨噬細胞,通過細胞膜上的醣脂神經節苷脂(GM1)侵入細胞後,到達並積聚在內質網中,誘導內質網緊迫反應,從而產生IL-1β的機制。該研究成果有望推動多種疾病相關的新型發炎控制藥物的開發。相關成果3月22日刊登於國際學術期刊《Cell Reports》上。
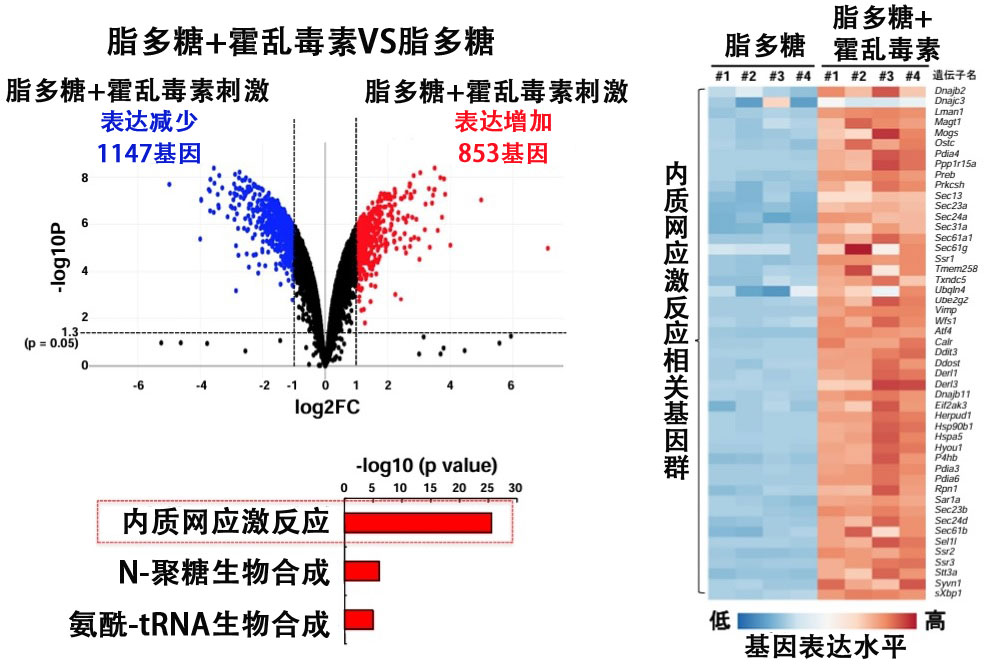
圖1 霍亂毒素誘導內質網緊迫反應(供圖:和歌山縣立醫科大學)
發炎小體是由病原體感測器、蛋白質切割酶及連接兩者的分子組成的蛋白質化合物。發炎小體有多種類型,根據各病原體感測器的名稱,被命名為NLRP3發炎小體或Pyrin發炎小體。通過這種酶的切割,IL-1β從非活性型轉變為活性型,並能夠表現出發炎誘導活性。
在病原體感染時,發炎小體通過病原體感測器識別病原體,並參與巨噬細胞產生IL-1β的過程,從而在寄主感染防禦中發揮必要作用。另一方面,當其在生物體內與代謝產物發生反應或功能過剩時,會導致自身發炎性疾病和糖尿病等慢性發炎性疾病的發病或惡化。目前已知構成因子的基因突變會造成自身發炎性疾病,如冷炎素(cryopyrin)相關週期熱症候群(cryopyrin-associated periodic syndromes,CAPS)和家族性地中海熱等。然而,由於難以在生物體內克隆,發炎小體具體是如何參與發炎病理的,其機制一直不甚清楚。
迄今為止,研究團隊報告了來源於霍亂弧菌的霍亂毒素會對小鼠腹腔中的常駐巨噬細胞產生反應,並誘導產生IL-1β。還揭示了霍亂毒素需要通過與細胞膜上的醣脂神經節苷脂(GM1)結合才能侵入細胞内,隨後激活NLRP3和Pyrin發炎小體才能發揮作用。但對於霍亂毒素如何激活炎性小體,此前一直不清楚。
因此,研究團隊將霍亂毒素注射到小鼠腹腔内,並對誘導的基因簇進行了全面分析。結果發現有853個基因在霍亂毒素刺激下表達量增加了兩倍以上,其中包括許多誘導內質網壓力響應的基因。
內質網壓力響應是一種消除結構異常的有害蛋白質的機制,這些蛋白質在內質網中積累,通過PERK和IRE1α等內質網壓力感測器的活性化引發降解處理或合成停止,從而維持體內平衡。
當通過免疫染色驗證霍亂毒素是否確實到達小鼠腹腔内的內質網時,發現其與IRE1α共存並積累。此外,在利用GM1缺陷型巨噬細胞進一步研究內質網反應是否必須通過與霍亂毒素GM1的結合侵入細胞時,結果發現在GM1缺陷型巨噬細胞無法侵入細胞内,並且不會誘導緊迫反應。
此外,當使用抑制劑檢測PERK或IRE1α內質網壓力感測器是否參與時,發現只有IRE1α參與IL-1β的誘導,這一結果在利用缺陷小鼠進行的實驗中也得到了證實。
霍亂毒素已被證明可以激活NLRP3和Pyrin發炎小體。因此,為了研究IRE1α參與激活哪種因子,研究團隊使用IRE1α缺陷的腹腔巨噬細胞並分別添加各種發炎小體激活因子,以研究IL-1β的誘導能力。結果顯示任何一種發炎小體活化因子的加入都會削弱產生IL-1β的能力。研究還發現,內質網壓力感測器IRE1α是兩種發炎小體活性化所必需的。
佐佐木講師表示:「還有其他未知的內質網壓力感測器,而它們的作用在免疫學領域尚未明確。此次,我們通過關注腹腔内的常駐巨噬細胞,希望可以進一步闡明其分子基礎。此外,腹腔中常駐的巨噬細胞也存在於人體中,因此可以推測人體內可能也存在類似機制。今後,我們將繼續開展面向人類治療的研究。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Cell Reports
論文:A stress sensor, IRE1α, is required for bacterial-exotoxin-induced interleukin-1b production in tissue-resident macrophages
URL:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00309-7













