岐阜大學糖鏈生命核心研究所的木塚康彥教授的研究團隊在與法國里爾大學、大阪大學、廣島大學的共同研究中,發現了一種阻止附著在蛋白質上的糖鏈延長的新機制。該成果有望推動明確骨骼形成機制以及利用糖鏈改變血液中蛋白質的穩定性。相關成果已發表在《Journal of Biological Chemistry》上。
研究概要圖(供圖:岐阜大學)
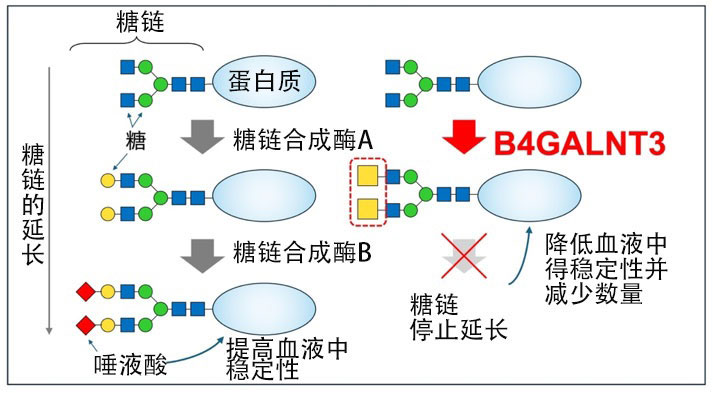
B4GALNT3是人類糖基轉移酶的一種,可作用於N-糖鏈和粘蛋白型糖鏈,延長附著在蛋白質上的糖鏈。B4GALNT3產生的糖鏈結構被稱為LDN(LacdiNAc),但許多其他N-糖鏈具有名為LacNAc的另一種結構,而非LDN。
通常,當糖鏈延長併附著LacNAc時,糖鏈會進一步延長並在末端附著口水酸。B4GALNT3缺失小鼠的血液中醣蛋白硬化素的濃度顯著升高,導致骨骼形成出現異常。然而,此前並未能闡明為何失去LDN後,血液中硬化素的濃度會升高。
木塚教授等提出了LDN的附著會使糖鏈難以延長的假設。相反,當缺乏B4GALNT3時,具有LacNAc的糖鏈將取代LDN而增加,並且糖鏈進一步延伸併附著口水酸,這可能會提高血液中蛋白質的穩定性。
研究人員首先在培養細胞内導入了B4GALNT3,然後檢測細胞表面存在的含口水酸的糖鏈,結果發現導入的培養細胞與未導入的培養細胞相比,口水酸含量更低。
為了驗證具有LDN的糖鏈上是否真的不附著口水酸,研究團隊分別製備了具有LacNAc的糖鏈和具有LDN的糖鏈,並與一種在糖鏈末端添加口水酸的酶(ST3GAL4)混合,觀察了口水酸是否會附著在糖鏈上。結果顯示,在具有LacNAc的糖鏈的末端附著了口水酸,而在具有LDN的糖鏈中幾乎沒有附著口水酸。
也就是說,當LDN附著在糖鏈上時,口水酸不再附著,糖鏈也不再延長。由此表明,B4GALNT3是一種通過控制糖鏈的延長來控制血液中蛋白質壽命的重要的糖基轉移酶。
對N-糖鏈末端的詳細研究表明,與口水酸一樣,末端存在的多種結構很難附著在具有LDN的糖鏈上。這意味著當B4GALNT3產生LDN時,不僅限於口水酸,同時還會使得N-糖鏈的重要末端結構無法產生,即B4GALNT3是N-糖鏈的結構和功能的一個重要調控因素。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Journal of Biological Chemistry
論文:LacdiNAc synthase B4GALNT3 has a unique PA14 domain and suppresses N-glycan capping
DOI:10.1016/j.jbc.2024.107450