日本理化學研究所(簡稱「理研」)生命機能科學研究中心染色體分配研究團隊的竹之内修基礎科學特別研究員、榊原揚悟基礎科學特別研究員(研究當時)、北島智也團隊負責人組成的研究團隊利用對分裂細胞的染色體逐一追蹤的新技術,揭示了老化卵子内部小染色體數量容易出現異常的原因。研究成果已經發表在期刊《Science》上。北島表示:「動態成像技術的開發使得我們第一次能夠觀察到每條染色體的運動。我們還希望將這項技術應用於受精卵胚胎發育機制等方面的研究。」

圖1 理研北島智也團隊負責人(右)和竹之内修基礎科學特別研究員在記者發布會上
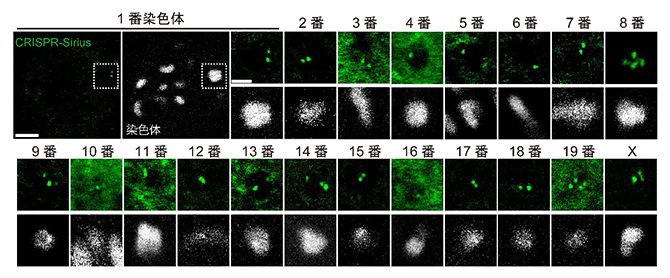
圖2 依託CRISPR-Sirius技術的染色體識別(供圖:理化學研究所)
白色表示染色體的形狀,綠色螢光點表示附著在每條染色體上的螢光探針信號。包含所有染色體的視角觀察圖示如1號染色體圖所示(左上兩圖,比例尺5微米(μm,1μm為百萬分之一米))。每條染色體的放大觀察圖像比例尺為3μm。在減數第一次分裂中,染色體會形成含有四個染色分體的二價染色體,每種染色體都可觀察到多個綠色螢光點。
此前,研究團隊曾分析過小鼠卵母細胞内的染色體分配異常,發現老化的卵母細胞内減數分裂過程中同源性染色對(二價染色體)的提前分離是染色體分離異常的原因。然而,僅憑以往的動態成像技術無法識別染色體,也無法瞭解特定的小染色體是因為何種過程導致了分配異常的。
為此,研究人員想到,如果將可以螢光標記活體細胞DNA序列的CRISPR-Sirius技術應用於小鼠卵母細胞,並對隻包含在一種染色體中的DNA序列進行螢光標記,即可將帶有螢光點的染色體識別為靶染色體。基於小鼠的基因體資訊,研究團隊篩選出了18萬2147種DNA序列作為標記候選,根據準確性等因素確定了其中的優先順序,並利用CRISPR-Sirius技術對其逐一進行標記。最終,研究人員篩選出可觀察到較強螢光點的DNA序列,成功開發了可識別小鼠卵母細胞内全部20種染色體(包括19種常染色體和X染色體)的螢光探針集。
研究團隊將螢光探針集與已經開發的在減數分裂期間自動追蹤染色體位置並獲取圖像的顯微鏡技術相結合,並將這種新型染色體分析技術命名為「染色體追蹤和識別法(Chromosome tracking-and-identification method)」。
研究團隊使用這種方法,分別分析了採集自年輕小鼠卵母細胞内的9種染色體(大染色體:1~3號染色體和X染色體,中大小染色體:8~9號染色體,小染色體:17~19號染色體)的動態情況。結果發現,在減數分裂期的前期和中期,小染色體傾向於向紡錘體的内側移動,大染色體則傾向於向外側移動。
此外,研究發現,越小的染色體沿紡錘體主軸延伸的時機往往越早。這一現象提示,卵母細胞會根據染色體大小改變其延伸時機,以調整染色體的動力學特性。
上了年紀的小鼠卵母細胞也和年輕的卵母細胞一樣,小染色體更易局部存在於紡錘體的内側。但在減數第一次分裂過程中,染色體越小,提前分離的頻率越高,有六成提前分離的染色體在減數第一次分裂的後期出現了分配異常。染色體的提前分離是由微管將染色體拉向紡錘體兩極的力量所致,因此研究人員通過每條染色體的延伸情況推算了微管作用於染色體的力量。位於紡錘體内側的染色體比外側的染色體伸得更長,染色體在紡錘體内側受到了更強的拉力,由此誘發了染色體早期分離。
竹之内研究員表示:「隨著年齡增長,染色體黏著分子的濃度會變低,染色體進入紡錘體内側後無法承受拉力,小染色體便會提前分離。」
當研究人員將最近開發的人工中節導入老化的卵母細胞,阻止染色體進入紡錘體内側後,染色體早期分離的頻率出現下降,這表明有可能使用人造中節來控制染色體的異常分離。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Science
論文:Live chromosome identifying and tracking reveals size-based spatial pathway of meiotic errors in oocytes
DOI:10.1126/science.adn5529













