學習院大學理學部生命科學科的添田義行助教、小池力(博士生)、高島明彥教授、椎葉一心助教、東京大學研究生院理學系研究科的吉村英哲助教、早稻田大學理工學術院的坂内博子教授等人組成的研究團隊發表研究成果稱,搞清楚了包括阿茲海默症在内的被統稱為「Tau蛋白病(tauopathy)」神經退行性疾病患者大腦中某些特定突變的Tau蛋白聚集過程。該成果有望加深對此類疾病病理的瞭解。相關研究成果已發表在國際學術期刊《Structure》7月20日號上。
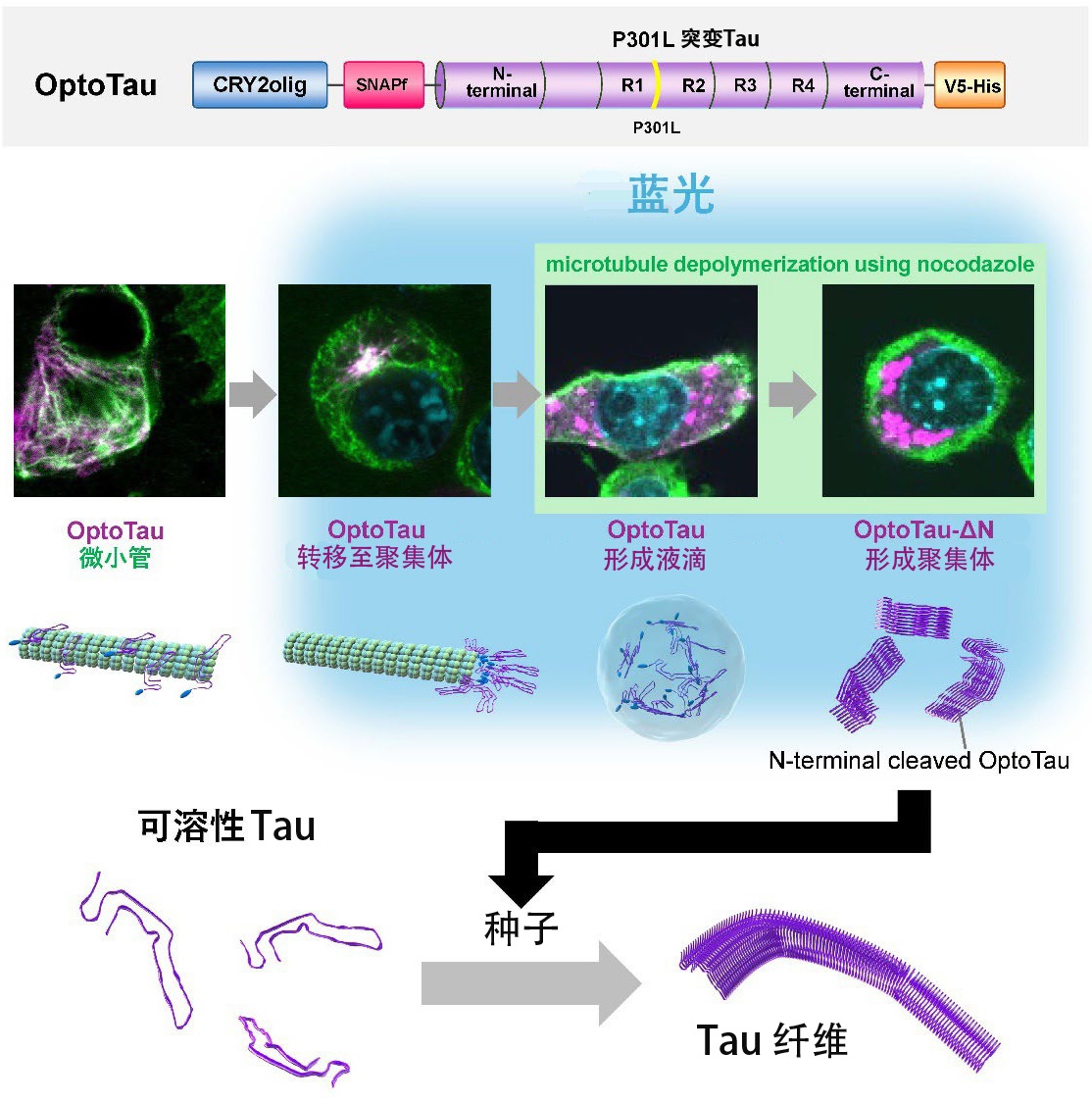
圖1 研究成果概要(供圖:學習院大學)
Tau蛋白存在於細胞中,並與穩定微管結構的細胞骨架相結合。另一方面,在阿茲海默症等神經退行性疾病中,Tau蛋白由於異常磷酸化而與微管脫離,並從水溶表徵態變成不溶性團塊。
此次研究人員使用帶有易於聚集的P301L突變的Tau蛋白與光敏蛋白CRY2olig相融合的Tau蛋白OptoTau,即時操縱了Tau蛋白在響應光照射下的行為變化。
通過使用光響應蛋白CRY2olig(一種源自植物擬南芥的突變蛋白),控制了Tau蛋白的運動,並獲得了研究解明疾病進展機制的線索。
在藍光照射下,OptoTau轉變為疾病中觀察到的磷酸化狀態,並促進了細胞内Tau簇的形成。據觀察,這些簇集中在細胞核周圍,並隔離在聚集體(一種用於處理聚集蛋白質的系統)中。
當使用微管形成抑制劑(諾考達唑)破壞聚集體時,OptoTau會通過藍光照射分散到整個細胞中變為非聚集體,形成無膜結構。這被認為是生命科學領域受關注的話題之一、液-液分離(兩種或兩種以上液體在不混合的情況下形成獨立層的現象)形成的液滴,由此得到了Tau蛋白從液滴狀結構轉變為固體團塊的過程。
此外,N端缺失的OptoTau在照射藍光時會形成比OptoTau更強的聚集體。這表明其發揮了將正常Tau轉化為Tau纖維的種子的功能。此外,還發現這種Tau具有將正常Tau轉化為異常聚集Tau的能力。
添田助教表示:「本研究是在新學術領域‘奇點生物學’的交流會上,與東京大學的吉村英哲助教以及早稻田大學坂内博子教授共同推進的。此外,也感謝我的上司高島明彥教授和各位論文合著者給予的大力支持,從而獲得了Tau蛋白誘導癡呆症的發展機制線索。今後,我們將利用這些成果挑戰尋找可能對Tau靶向認知症藥物開發有幫助的抑制劑。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Structure
論文:Intracellular Tau Fragment Droplets Serve as Seeds for Tau Fibrils
DOI:doi.org/10.1016/j.str.2024.06.018













