東京醫科齒科大學難治疾病研究所的岡澤均教授、吉岡優希博士生(現為特任助教)、黃勇博士生、田中HiKaRi講師、藤田慶大兼職講師(金澤大學特任副教授)、本間秀典特任副教授等組成的研究團隊與金澤大學的安藤敏夫特任教授等人開展的一項聯合研究表明,岡澤教授等人發現的分子「PQBP3」機能下降,可以在分子水平上解釋老化與神經退行性疾病病理之間的關聯性。岡澤教授表示:「PQBP3機能下降可能在大腦神經元中同時引發細胞衰老和神經退行,因此以PQBP3為靶點的治療有可能改善兩者的情況。但是,在非神經元的分裂細胞中,PQBP3被研究報告為癌症的風險因素。這意味著開發激活PQBP3以抑制老化和神經退行的藥物,必須利用高度神經元選擇性表達調控機制等技術手段。」相關研究成果已發表在期刊《EMBO Journal》上。

岡澤均教授
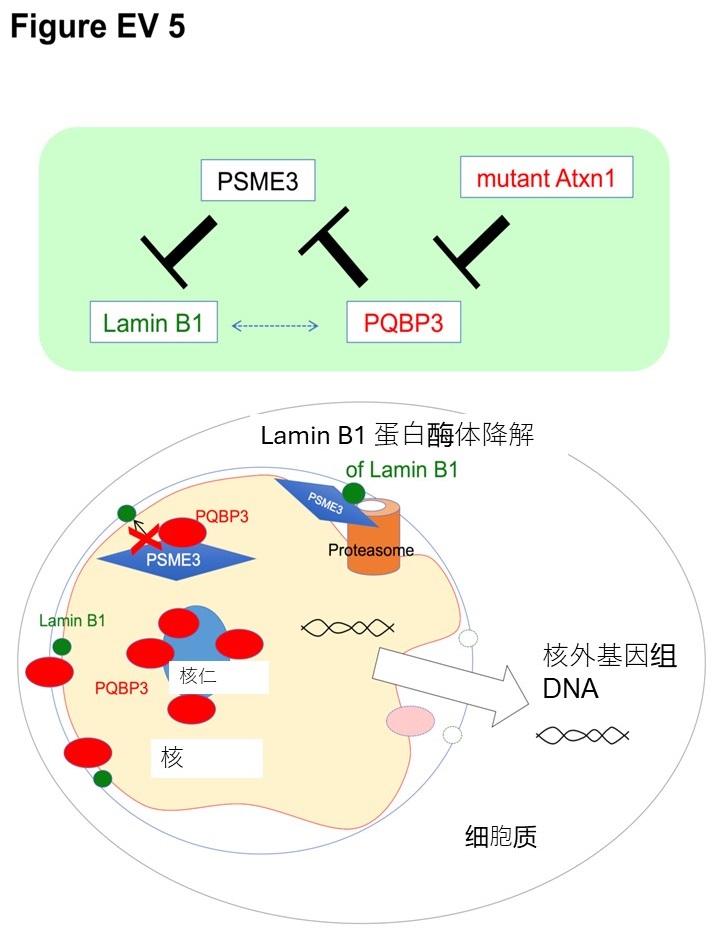
圖1 PQBP3一般儲存在核仁中,正常情況下,它的一部分會轉運到核膜上,防止PSME3誘導的核膜內層蛋白質Lamin B1降解。
在細胞衰老過程中,PQBP3會通過mTOR信號激活差排到細胞質中,從而導致細胞核和核膜內層處表達缺失。此外,在多聚麩醯胺疾病(如SCA1)中,PQBP3會被疾病蛋白質聚集的包涵體所吸引,這也會導致PQBP3轉移到細胞質中,從而造成核和核膜內層部位的表達缺失。(供圖:東京醫科齒科大學)
老化是神經退行性疾病的最大風險因素,所以老化與神經退行性疾病之間的關聯性備受關注。儘管從皮膚等組織中清除老化細胞的治療方法正在取得進展,但由於神經元清除後無法再生,這種治療方法無法應用於神經退行性疾病。從這個角度來看,老化與神經退行性疾病之間的相關也至關重要,但目前研究者對其分子基礎的理解仍不充分。
作為與麩醯胺病的致病蛋白質結合的蛋白質,岡澤教授的團隊早在20多年前就特定出了PQBP1、PQBP3、PQBP5、VCP,在這些蛋白質中,唯獨對PQBP3的機能還不甚瞭解。
研究團隊此次開展的研究顯示,在細胞衰老過程中,PQBP3會從細胞核中減少;在神經退行性疾病病情進展過程中,PQBP3會與疾病蛋白質結合併從細胞核中減少;PQBP3具有保持核膜穩定性的功能。研究明確了神經元細胞的老化和退行性疾病均存在PQBP3機能下降現象。
「此前有很多研究生參與了這個項目,當我仔細觀察他們的數據時,注意到核仁中PQBP3出現的現象與DNA在細胞内的分佈之間存在某種關聯性,這正是此次研究的契機。我們由此全力推進解析,最終揭示了相關的全貌。」(岡澤)
具體來說,PQBP3在核仁中出現了以下現象:PQBP3一般儲存在核仁中,在常態下,它的一部分會移動到核膜上,從而抑制PSME3誘導的核膜內層蛋白質Lamin B1的降解。當細胞衰老時,PQBP3會通過mTOR信號激活差排到細胞質中,導致在細胞核和核膜內層處的表達不足。此外,在類似脊髓小腦共濟失調症1型(SCA1)這樣的多聚麩醯胺病中,PQBP3會被疾病蛋白質聚集的包涵體所吸引,這同樣會導致PQBP3轉移到細胞質中,造成在細胞核和核膜內層處表達不足。
岡澤教授表示:「所有的PQBP都是天然變性蛋白質,天然變性蛋白質之間的液-液相分離(LLPS)現象可能在神經退行性疾病中發揮了作用。目前這種現象還隻在小鼠大腦中觀察到,但如果將來能從體外觀察到人腦中的LLPS,或許就能捕捉到神經退行性疾病的徵兆。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:The EMBO Journal
論文:PQBP3 prevents senescence by suppressing PSME3-mediated proteasomal Lamin B1 degradation
DOI:doi.org/10.1038/s44318-024-00192-4













