北陸先端科學技術大學院大學物質化學前緣研究領域的都 英次郎教授及其研究團隊發表研究成果稱,成功製造出了在奈米碳管之一的碳奈米角(CNH)表面包覆癌細胞成分和抗癌藥物的奈米粒子,並在小鼠身上證實了這種粒子不僅具有奈米粒子特有的高滲透長滯留效應(EPR效應),還能發揮對多種癌症的治療作用。這種粒子對機體的影響極小,有望創造出奈米粒子與近紅外光雷射相結合的新型癌症診斷和治療技術。相關研究成果已於8月19日發表在國際學術期刊《Small Science》上。
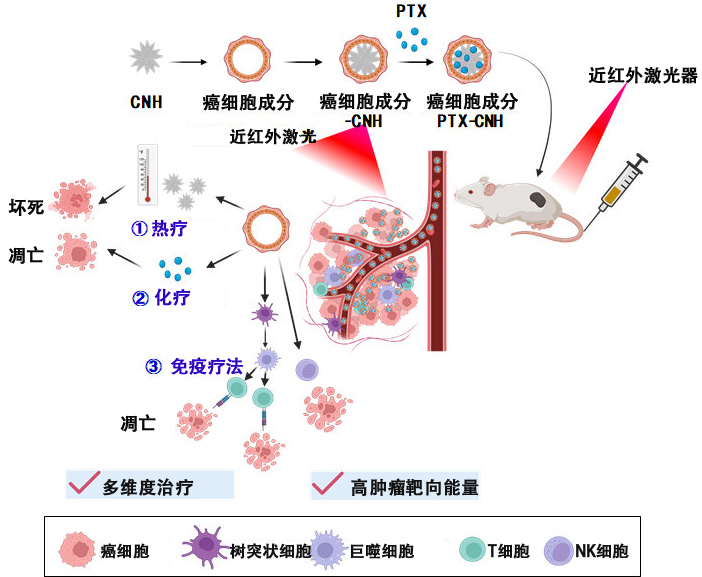
圖1 包覆癌細胞成分的奈米粒子的製造過程及其研究概念。(供圖:北陸先端科學技術大學院大學)
已知癌細胞有躲避免疫細胞攻擊的特殊細胞膜功能,且癌細胞内的組成成分(基因和蛋白質等)具有增強免疫活性的作用。
都教授此前發現,CNH不僅具有較高的生物相容性和優秀的物理化學特性,還具有在生物滲透性較高的波長區域(650~1100奈米)的雷射照射下容易發熱的特性,因此一直致力於開發利用這一特性的癌症診斷和治療技術。
另一方面,CNH具有因分子間相輔作用較強而難以在水等介質中分散,從而聚集的性質。該問題可通過在CNH表面化學修飾聚乙二醇(PEG)等水溶性聚合物來解決,但這種方法存在反復給藥導致血液滯留性失落和引發過敏的問題。
此次新開發的技術通過操作簡便的超音波照射,使癌細胞成分吸附在CNH表面,從而使CNH能夠分散在水溶液中。此外還通過利用癌細胞成分,成功地將難溶於水的抗癌藥物「紫杉醇(PTX)」同時包覆在了CNH表面。
研究證實,通過該方法製備的癌細胞成分-PTX-CNH化合物可保持粒徑穩定性超過30天,對細胞具有較高的細胞膜滲透性,並表現出了抗癌效果。研究還證實該物質在近紅外光雷射照射下會發熱,由此進一步驗證了該技術在癌症病竈的視覺化與治療效果的潛力。
在癌症病竈的視覺化方面,研究團隊利用了一種將可用於癌症診斷的近紅外光螢光色料「吲哚菁綠(ICG)」與癌細胞成分一起結合到CNH表面的奈米粒子(癌細胞成分-ICG-CNH化合物)。
當研究人員向移植大腸癌後約10天的小鼠投用癌細胞成分ICG-CNH化合物,並在24小時後用近紅外光光(波長740-790奈米)照射後,結果得到了癌症病竈發出螢光的圖像。
用波長為808奈米的近紅外光雷射照射癌細胞成分-ICG-CNH化合物聚集的病竈後,研究發現,在癌細胞成分產生的血液滯留效應、腫瘤内浸潤作用、免疫活化能力、抗癌藥物產生的藥效,以及CNH的光熱轉換產生的效果的聯合作用下,成功在兩天後完全消除了癌症。
此外,進一步研究腫瘤内部的藥效機制時發現,雷射照射後癌細胞成分-ICG-CNH化合物中,細胞毒性較高的T細胞和自然殺傷(NK)細胞等免疫細胞被激活。
都教授表示:「此次開發的技術的特點是將癌症的靶向療法、光熱療法、化療和免疫療法等多種療法的優勢整合在了一個平台上,我們希望它能為癌症治療,特別是轉移性癌症的治療提供一種有效且精準的方法。此外,我們也在積極開展安全性試驗法等方面的研究,目標是在10年内開展臨床試驗。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Small Science
論文:Biomimetic functional nanocomplexes for photothermal cancer chemo-immunotheranostics
DOI:10.1002/smsc.202400324













