日本醫藥基礎・健康・營養研究所(NIBIOHN)新藥研發設計研究中心副主任足立淳等人的研究團隊與國立癌症研究中心及京都大學合作,通過高精度磷酸化信號解析技術明確了新的胃癌治療靶點。研究團隊此次開發出了一種能夠評估患者個體的磷酸化信號特性的技術,並明這種確特性可分為三種亞型,成功發現了新的治療靶點。該研究成果將有望促進開發治療方法。相關成果已於10月1日發表在國際學術期刊《Cell Reports》上。
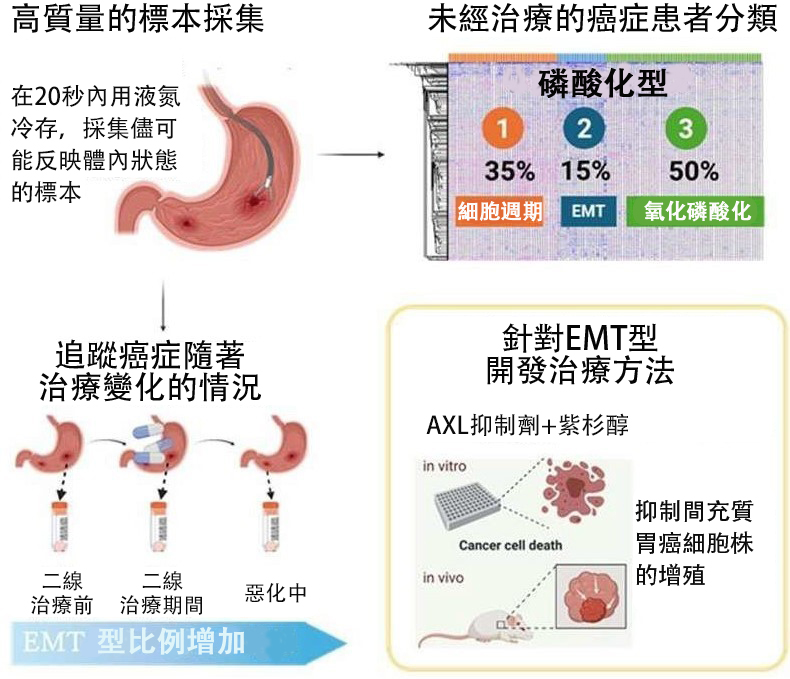
圖1 從使用內視鏡活檢標本的磷酸化信號解析到開發治療方法的研究概要(供圖:醫藥基礎・健康・營養研究所)
胃癌的患病人數和死亡人數在癌症中居第三位,尤其是不能切除的晚期胃癌的預後效果非常差,中位生存期約為12個月。適用於晚期胃癌的有效分子靶向藥物目前還十分有限。
由於用作抗癌藥的分子靶向藥物大多直接作用於蛋白質,癌細胞内部所有蛋白質(蛋白質組)整體的資訊有望對治療方法的選擇發揮作用。鑑於通過磷酸化修飾的磷酸化信號能夠對癌細胞的多種功能加以控制,所以人們希望這種解析能夠應用於「癌症精準醫療」中。
此前,研究團隊已經開發出了一種利用内鏡檢查中採集並立即冷凍的微量活檢標本來解析磷酸化信號的技術,並報告了患者在接受曲妥珠單抗(Trastuzumab)治療前後的應答率存在的差異。
在本次研究中,研究團隊改進了此前的信號分析方法,對未經治療的胃癌患者的127個標本進行了磷酸化信號解析。
解析結果顯示,每個標本平均有2萬1103個磷酸化位點被成功量化,其中的35%被歸類為亞型1「細胞週期調控激酶群被激活型」,15%被歸類為亞型2「上皮-間質轉換(EMT)型」,50%被歸類為亞型3「氧化磷酸化亢進型」。
研究團隊以9名無法切除的晚期癌症患者為對象,對其一線治療(化療)後、二線治療期間和惡化中的磷酸化信號進行了解析,結果發現,亞型2會隨著治療的進行而增加,轉變為對藥物反應較差的高惡性程度。
目前已知,構成亞型2的間充質癌細胞對化療、分子靶向治療、免疫治療有耐性且容易轉移,所以預後不良。
為此,研究團隊著眼於亞型2中已被激活的接受者型酪胺酸激酶「AXL」,並在培養胃癌培養細胞時將兩種AXL抑制劑分別添加到紫杉醇中,觀察其增殖抑制效果。結果發現,僅在AXL活性較高的間充質胃癌培養細胞中確認到了AXL抑制劑的增效作用。
此外,在移植了間充質胃癌培養細胞形成腫瘤的小鼠實驗中,通過聯合使用AXL抑制劑和紫杉醇,發現也抑制了腫瘤細胞的增殖。
上述技術的重要性在於,能夠在治療前和治療期間的進行動態解析,可用於追蹤患者個體的癌症對藥物產生的變化,能夠確定作為靶點的酪胺酸激酶等物質。
足立副中心主任表示:「我們花了大約6年時間開發出了精確監測人體內磷酸化信號的技術。此次以胃癌為對象進行了研究,揭示了癌症的狀態會隨著治療的進行而產生動態變化,這將有助於開發新的治療方法。今後我們計劃繼續推進研究,並將對象擴展至胃癌以外的癌症。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Cell Reports
論文:Phosphoproteomic subtyping of gastric cancer reveals dynamic transformation with chemotherapy and guides targeted cancer treatment
DOI: doi.org/10.1016/j.celrep.2024.114774













