由日本理化學研究所腦神經科學研究中心團隊負責人西道隆臣和長崎大學研究生院醫齒藥學綜合研究科教授岩田修永等組成的國際聯合研究團隊宣佈,明確了阿茲海默症患者大腦中β-澱粉樣蛋白(Aβ)轉變為難以降解的有害物的生成機制。研究人員對經人為操作使中性内肽酶(降解Aβ的酶)失活的阿茲海默症小鼠模型進行分析,結果發現在該小鼠體內,通常不發揮作用的其他酶開始分解Aβ,而在此過程中,Aβ會被添加一種阻礙分解的修飾,從而導致有害Aβ不斷積累。這一發現有望推動新型治療藥物的開發。相關研究成果已於9月30日發表在國際學術期刊《Life Science Alliance》上。
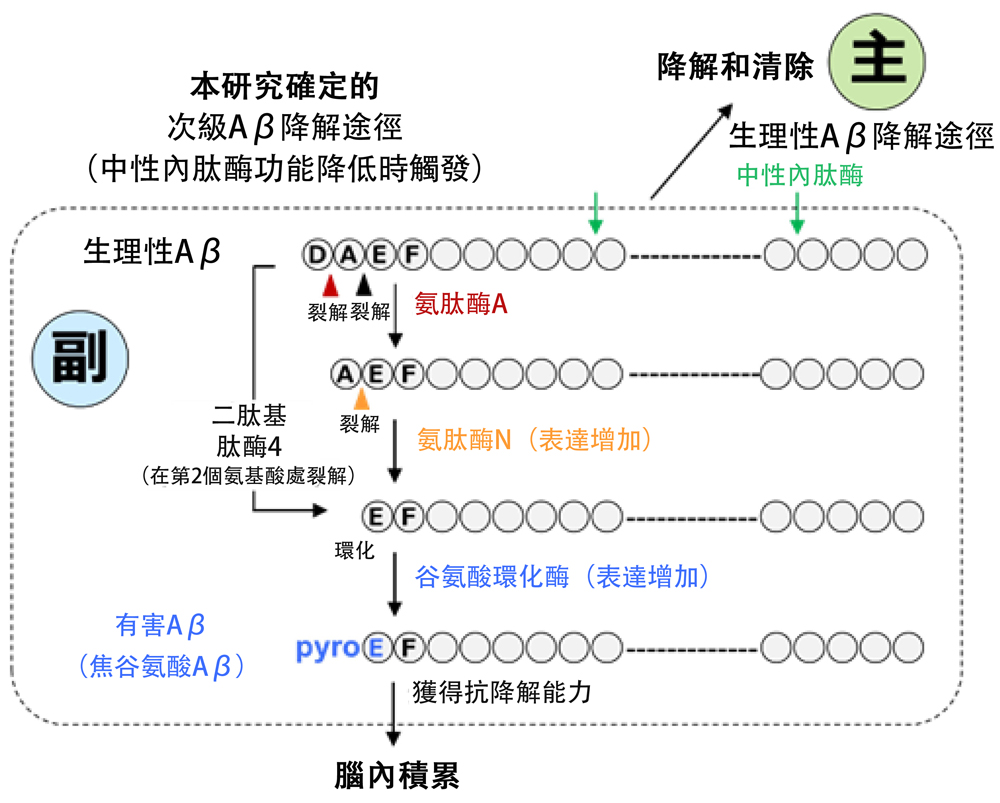
圖 有害Aβ的生成機制(供圖:理化學研究所)
阿茲海默症(AD)患者大腦中積累並形成澱粉樣蛋白斑塊的Aβ大部分是被稱為 「PyrogluAβ」的有害Aβ,其自聚集能力較正常生理性Aβ高出250倍左右,且在結構上與正常大腦中產生的生理性Aβ存在差異。研究人員發現,生理性Aβ會被中性内肽酶降解和清除,但AD患者大腦生成中性内肽酶的能力嚴重減弱。
研究人員發現,大腦中的Aβ會反復生成和降解,並隨著時間推移在大腦中逐漸積累,直至患上AD,在此期間,胺基末端結構會受到各種修飾。
由於「PyrogluAβ」具有高聚集性,所以針對Aβ積累量等進行的定量分析此前一直未取得深入進展。此外,從生理性Aβ轉變為有害Aβ的機制也並不明確。
在本研究中,為區分大腦中一定量存在的Aβ,研究團隊通過化學合成了用放射性同位素標記的具有多種氨基酸末端結構的Aβ,之後將其注射到大鼠的海馬區域中,並分析了降解速率。
結果表明,生理性Aβ和僅去除氨基酸末端氨基酸的Aβ降解迅速,而去除氨基酸末端且具有環狀結構的「PyrogluAβ」降解極為緩慢。使用獨特性抗體對AD患者腦樣本中多種Aβ的豐度進行定量分析後發現,「PyrogluAβ」佔總量的40%以上,而生理性Aβ的含量還不到5%。
在對傳統AD模型小鼠和經基因工程改造使中性内肽酶失活的新一代AD模型小鼠進行的分析中,AD模型小鼠腦中與生理性Aβ具有相同氨基酸末端結構的Aβ含量在12月齡前高於中性内肽酶正常工作的模型小鼠,之後差異縮小。在中性内肽酶失活的模型小鼠腦中,「PyrogluAβ」的積累與月齡有關,在24月齡時達到2.5倍。
此外,研究人員利用迄今為止尚未實現的質譜分析法設計了一種檢測「PyrogluAβ」的初步處理方法,通過利用匹茲堡化合物B(PiB)作為成像探針,成功通過PET捕捉到腦内「PyrogluAβ」增加的情況。
研究表明,「PyrogluAβ」會裂解生理性Aβ氨基酸末端的2個氨基酸,其中第3個麩胺酸會形成環狀結構。在此之前,研究團隊負責人西道已證明,「PyrogluAβ」的生成涉及外肽酶(如氨肽酶和二肽基肽酶),這些酶能夠肽的胺基末端裂解氨基酸。
為此,研究人員研究了外肽酶在中性内肽酶失活的情況下補償Aβ降解的可能性。研究人員重點研究了氨肽酶、二肽基肽酶和麩胺酸環化酶在Aβ降解中的潛在作用,發現當與Aβ發生反應時間,這些酶均具有足夠的裂解活性。研究還發現,在中性内肽酶失活的AD小鼠模型中,腦内氨肽酶和二肽基肽酶的表達水平隨著年齡增長而增加。
這些酶具有裂解活性,但在降解過程中,抵製降解的「裝飾性」麩胺酸環化酶會附著在Aβ上,從而阻止降解,導致有害Aβ逐漸積累。
與可靶向清除已在大腦中積累的「PyrogluAβ」的藥物多奈單抗(Donanemab)不同,研究顯示,通過抑制「PyrogluAβ」生成有害轉化的外肽酶(氨肽酶和二肽基肽酶)以及焦谷氨酰環化酶,有望在「PyrogluAβ」形成前阻止其的積累。
研究團隊負責人西道表示:「目前,獲得美國FDA、日本厚生勞動省等批准的用於阿茲海默症治療的抗體藥物有兩種:侖卡奈單抗和多奈單抗(Lecanemab和Donanemab)。後者可識別西道(理化學研究所)和井原(東京大學)於1995年發現的Pyroglutamic Aβ,前者是一種由蘭費爾特(Lars Lannfelt,瑞典烏普薩拉大學)等開發的可識別可溶性Aβ寡聚體的抗體。由於這些抗體具有不同的表位(抗體在分子水平上識別的位點),因此同時使用可能會產生疊加效應。但需注意大腦出血等副作用」。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Life Science Alliance
論文:Metabolic resistance of Aβ3pE-42, a target epitope of the anti-Alzheimer therapeutic antibody, donanemab
DOI:10.26508/lsa.202402650













