阿茲海默症的原因之一是腦内異常積聚的β-澱粉樣蛋白(Aβ)。Aβ堆積後形成被稱為「纖維」的團塊,會對神經細胞造成不良影響。儘管阻止Aβ纖維生長被認為是治療阿茲海默症的關鍵,但其生長過程和停止機制此前並未被詳細解析。
圖1 研究示意圖(供圖:自然科學研究機構生命創成探究中心/分子科學研究所,Copyright © 2024 The Authors)
日本自然科學研究機構生命創成探究中心與分子科學研究所的加藤晃一教授(名古屋市立大學研究生院藥學研究科教授)、名古屋大學研究生院理學研究科的内橋貴之教授以及筑波大學精密醫學開發研究中心的研究團隊,利用作為最先進技術的高速原子力顯微鏡(HS-AFM),對Aβ纖維生長過程進行了分子水平的即時觀察。觀察的結果表明,一條Aβ纖維由兩條初纖維(protofilament)構成,通過Aβ分子交替結合方式使纖維延伸。
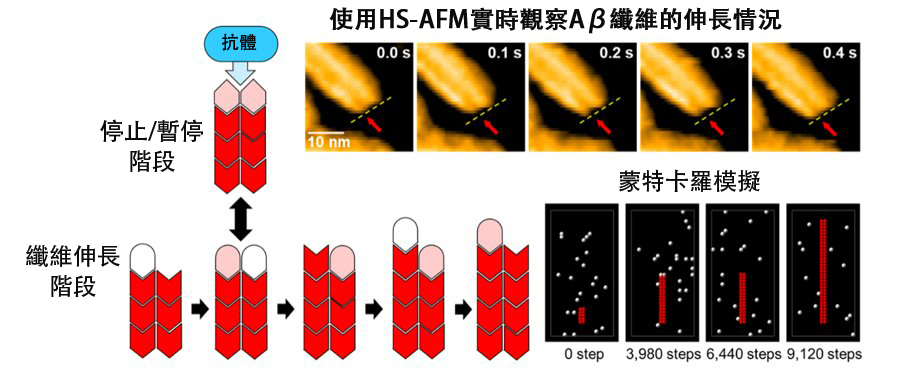
圖2 結合高速原子力顯微鏡(HS-AFM)和蒙地卡羅模擬,研究人員捕捉到了β-澱粉樣蛋白(Aβ)纖維交替延伸與停止的情況。揭示了4396C抗體選擇性結合纖維生長的「停止狀態」並有效抑制Aβ纖維進一步生長的機制。(供圖:自然科學研究機構生命創成探究中心/分子科學研究所,Copyright © 2024 The Authors)
研究還進一步發現,當兩條初纖維的末端處於對齊狀態時,纖維的生長會暫停並會頻繁進入一種「停止狀態」。這種停止狀態是Aβ纖維生長過程中自然出現的重要步驟。
研究還發現,一種名為「4396C」的獨特性抗體會選擇性結合處於「停止狀態」的纖維末端,有效阻止纖維的進一步延伸。這一發現揭示了Aβ纖維生長完全停止,進展受到抑制的機制。
這項研究闡明瞭Aβ纖維的生長會重複交替延伸與停止的獨特機制。它解明瞭參與阿茲海默症進展的新要素,為開發針對Aβ纖維「停止狀態」的新治療方法提供了可能性。
未來,研究團隊計劃通過進一步解析4396C抗體的作用機制,以實現抑制Aβ纖維生長的新型療法。此外,研究團隊還計劃以此次成果為基礎開展進一步的研究,旨在將該技術應用於其他澱粉樣蛋白相關疾病。
相關研究成果已線上發表於期刊《Journal of the American Chemical Society》上。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Journal of the American Chemical Society
論文:Single-molecule kinetic observation of antibody interactions with growing amyloid β fibrils
DOI:doi.org/10.1021/jacs.4c08841













