順天堂大學醫學部耳鼻咽喉科講座的神谷和作副教授與宇梶太雄兼職助教、東京大學研究生院理學系研究科的濡木理教授等人的研究團隊發表研究成果稱,成功開發出了可根治顯性遺傳型聾的基因體編輯技術。通過將腺相關病毒載體與基因體編輯技術相結合,成功將比既往更大尺寸的基因輸送到內耳細胞中。在小鼠實驗中確認,可使聾的內耳異常隙型連結蛋白恢復正常功能。預計5到6年後將啟動臨床試驗。該成果有望成為遺傳型聾的根治性療法。相關成果已發表在國際學術期刊《JCI Insight》的月10日刊上。
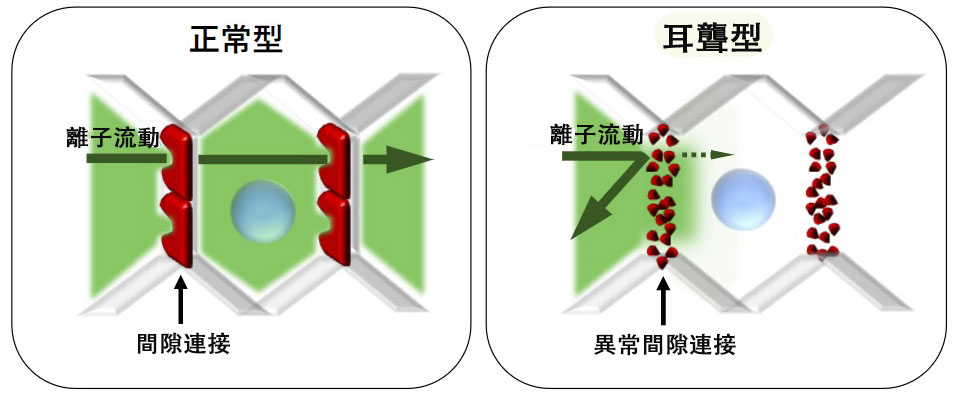
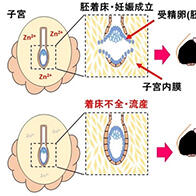
圖1 GJB2基因變異型聾病理機制
通常通過隙型連結可維持內耳的離子濃度恆定,但遺傳性聾患者由於GJB2基因變異產生的異常隙型連結,使得離子濃度無法再保持恆定。由此,導致離子環境穩定狀態失衡進而引發聾。(供圖:順天堂大學)
與遺傳性聾相關的基因有130種以上,其中約48%由GJB2基因變異引起。該基因是構成內耳「隙型連結」的蛋白質,正常的隙型連結可以使內耳的離子濃度保持恆定,從而保障聽覺功能正常運作。而變異蛋白質會導致離子環境的穩定狀態遭到破壞,從而引發聾。
迄今為止順天堂大學的研究團隊已經明確了由該基因變異導致出現異常隙型連結而引發聾的機制,並成功通過向聾模型小鼠補充GJB2基因,使其聽力得以恢復。
而在顯性遺傳類型的變異中,由於變異產生的異常蛋白質會阻礙內耳功能,因此僅導入正常基因無法恢復功能。針對這種情況的治療,需要能夠正常改寫變異部分的基因體編輯技術、以及能夠遞送該基因的載體。作為傳統載體使用的腺相關病毒載體(AVV)能夠運載的基因上限約為4.7Kbp,而用於基因體編輯的基因體尺寸更大。而且,能夠進行編輯的基因位點也存在限制。
為此,研究團隊此次採用了獨特的基因遞送技術和基因體編輯技術——順天堂大學開發了能夠遞送該基因的病毒載體AVV「AVV-Sia6a」,東京大學則開發了搭載基因尺寸小、靶向範圍廣的新型基因體編輯技術「SaCas-NNGABE」的內耳基因體編輯載體。據悉,這兩項技術均已申請專利。
研究人員使用這種病毒載體,對顯性遺傳型GJB2基因變異型聾模型小鼠和模型細胞進行了基因體編輯治療。
結果顯示,單次給藥就能高效地修復目標基因變異。在模型小鼠和模型細胞中均觀察到正常隙型連結蛋白的結構體,證實了其正常的物質運輸能力已得到恢復。在模型細胞中,編碼GJB2基因中精胺酸的序列C轉變為T會引發聾,而給藥後也確認到約50%的T已修復為正常的C。
神谷副教授表示:「應用該技術能夠針對此前未曾成為基因療法開發對象的、尺寸較大的聾基因以及各種變異類型進行治療,推動聾治療技術的飛躍發展。目前,我們正從患者那裡獲取細胞並製備iPS細胞,首先計劃利用這些細胞來評估治療效果。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:JCI insight
論文:AAV-mediated base editing restores cochlear gap junction in GJB2 dominant-negative mutation-associated syndromic hearing loss model
DOI:doi.org/10.1172/jci.insight.185193