近年來,培養iPS細胞等幹細胞並移植給人體的「再生醫學」備受關注。然而,體外培養即使在相同條件下仍無法實現組織形狀的均一化,尚未達到器官立體形狀的準確再現地步。因此,需要明確器官形態形成的機制,並需要在試管內控製該過程。在器官形成過程中,片狀上皮組織會類似摺紙那樣複雜摺疊,形成各種器官的形態。儘管目前已知摺痕具有不可逆性,但其中的機制尚未明確。
發現組織的響應會根據組織的變形時間和量而切換
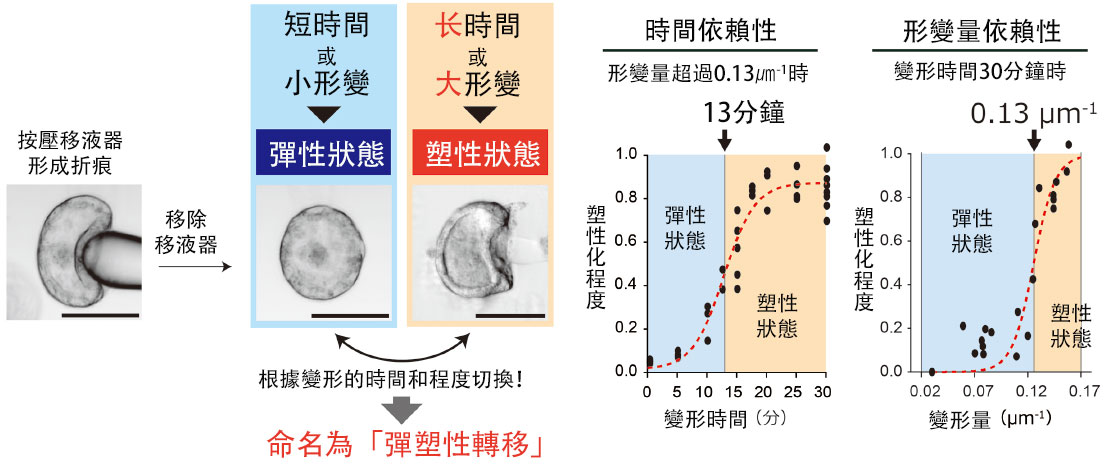
給組織施加外力時發生變形,撤力後恢復原狀的特性稱為「彈性」;撤力後不恢復原狀的特性稱為「塑性」,兼具這兩種特性的稱為「彈塑性」。研究團隊通過實驗揭示了摺痕對時間與形變量的依賴性。
金澤大學奈米生命科學研究所奧田覺副教授的研究團隊,開發出了可對活體上皮細胞片施加複雜三維變形的新技術,並將其應用於脊椎動物眼原基的眼杯類器官和小鼠胚胎的眼組織。研究發現上皮細胞片摺痕的不可逆性會隨著施加變形的「時間」與「形變量」發生改變,並將這一現象命名為「彈塑性轉移」。具體而言,當施加形變超過13分鐘,表徵曲率變化的形變量超過0.13微米(1微米=百萬分之一米)時,摺痕將固定並無法複原。
為探究這種變化在閾值附近呈現階躍式變化的原因,研究團隊關注了與細胞形態維持及形變相關的肌動蛋白分子。通過可直接觀察活體組織的螢光即時成像技術發現,肌動蛋白分子在摺痕內側聚集,形成了類似L型金屬件的「肌動蛋白支架」結構。
本次研究發現:細胞通過感知上皮細胞片所受形變的時間與量形成肌動蛋白支架,進而控制摺痕的不可逆性。這一發現解答了「為何器官形狀一旦形成便不可逆」這一發育生物學中的根本性疑問,並有助於為組織工程和再生醫學領域的技術創新做出貢獻。(TEXT:JST廣報課中島彩乃)
原文:JSTnews 2025年3月號
翻譯:JST客觀日本編輯部