日本國立研究開發法人原子能研究開發機構(JAEA)原子能基礎工學研究中心的甲斐健師研究主幹,與茨城大學研究生院理工學研究科的橫谷明德教授、以及北海道大學研究生院保健科學研究院的松谷悠祐講師、京都大學研究生院工學研究科的土田秀次副教授等共同發表成果稱,明確了輻射致癌的起點——DNA傷害機制。通過模擬計算發現,即使在低劑量條件下,輻射分解水分子產生的電子和OH自由基同時與DNA發生反應,具有導致複雜的DNA傷害的可能性。這一發現有望為輻射防護策略提供科學支持。相關研究成果已發表在國際學術期刊《Communications Chemistry》的3月6日刊上。
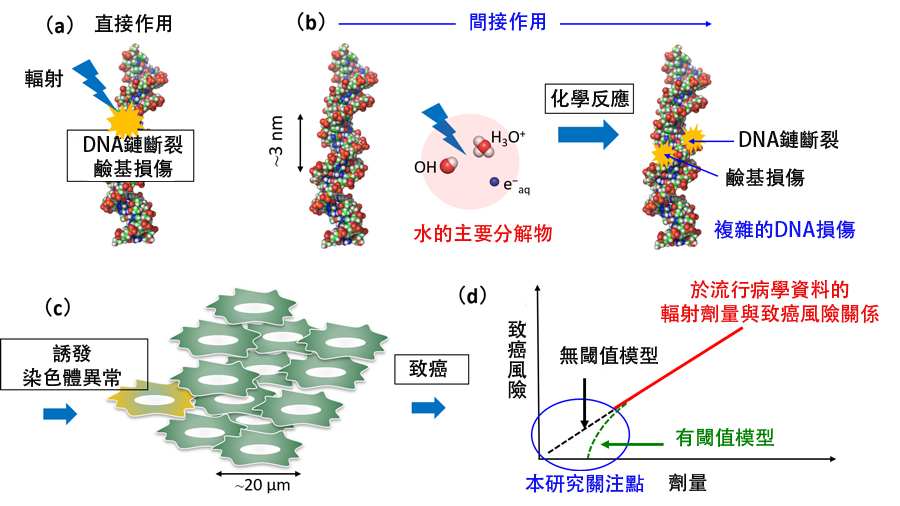
圖1. 本研究探討的輻射暴露致癌風險過程。(b)為本研究成果。(供圖:JAEA)
由於輻射致癌的風險評估缺乏低劑量區間(100毫西弗)的流行病學數據,目前主要依賴模型推算。實驗檢測DNA傷害的技術尚未取得突破。另一方面,還存在「有閾值」和「無閾值」兩種致癌劑量模型,此前學術界尚未明確哪種模型正確。
已有利用人工DNA的實驗表明,DNA傷害作為致癌風險的初期因素,雖然這種傷害孤立存在時可被迅速修復,但若在10個鹼基對範圍內形成多重傷害(簇集傷害),修復蛋白對傷害部位的切除修復效果會下降。這將引發致癌風險。
此次研究團隊聚焦於DNA附近生成的輻射分解物與DNA反應引發的間接傷害,對包含DNA的水溶液中H3O+、OH自由基、水合電子的隨機擴散運動進行了計算。
本次研究假設一束輻射線在距離 x 奈米處命中 DNA,設定逸出電子(spur)的半徑為α奈米,在此條件下計算了生成分解物的熱擴散運動。然後評估生成分解物與DNA的化學反應。由此實現了對孤立傷害和簇集傷害產量的評估。
結果顯示,當只有OH自由基與DNA反應時間,將形成易修復的孤立傷害;而當OH自由基與水合電子同時與DNA反應時間,將形成難修復的簇集傷害。關於簇集傷害,當在DNA極近旁(1.5奈米內)賦予水分子輻射能量並產生多個分解產物時,雖然發生概率不足1%(約為孤立傷害的1/50),但發現仍可能形成簇集傷害並致癌。
研究團隊指出,此次研究結果為無閾值模型的觀點提供了支持。
甲斐研究主幹表示:「本次研究針對所謂低劑量輻射的影響展開,未來計劃將研究拓展至癌症治療等涉及的高劑量區域。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Communications Chemistry (Nature Portfolio)
論文:Multiple DNA damages induced by water radiolysis demonstrated using a dynamic Monte Carlo code
URL:https://www.nature.com/articles/s42004-025-01453-x