信州大學尖端領域融合研究群生物醫學研究所的平塚佐千枝教授與岐阜大學應用生物科學部的上野義仁教授的研究團隊宣佈,通過從體外施用人工合成的短鏈修飾mRNA,在小鼠模型中成功抑制了癌細胞轉移。研究還證實,利用合成修飾mRNA可激活癌症患者的抗轉移免疫細胞,抑制人類癌細胞的轉移。該成果有望應用於癌症轉移的預防及早期治療藥物的研發。相關研究成果已發表在國際學術期刊《Nature Communications》的2月25日刊上。
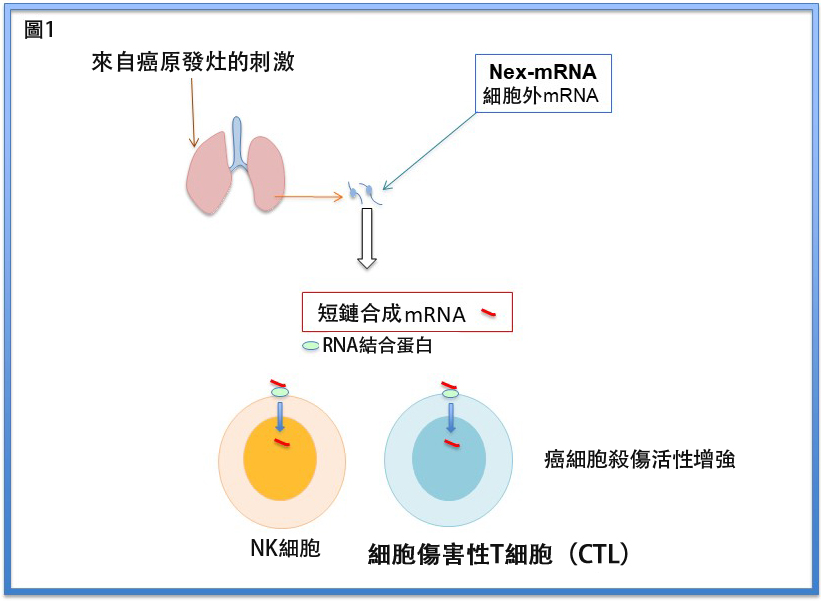
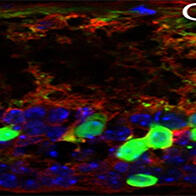
圖1 免疫細胞(NK細胞和細胞毒性T細胞)被短鏈合成mRNA激活(供圖:信州大學)
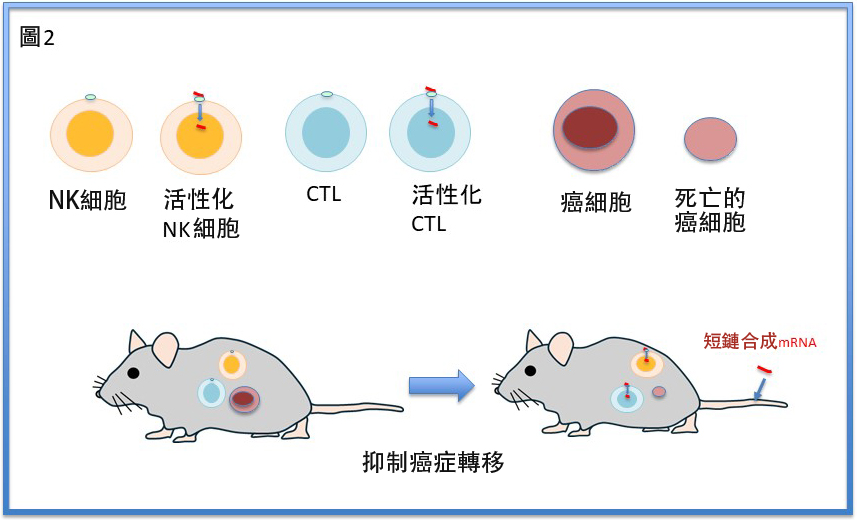
圖2 對移植了癌細胞與免疫細胞的小鼠施用短鏈合成mRNA後,使得免疫細胞活性化,癌細胞死亡,從而抑制了癌症轉移(供圖:信州大學)
目前已知超過90%的癌症死亡由轉移擴散導致,轉移受癌細胞以及轉移目標器官所在環境的雙重因素的影響。
轉移目標器官中存在少量具有抑制癌症轉移功能的抗轉移免疫細胞。細胞表面會表達mRNA的接受者蛋白,通過結合未被囊泡包裹的細胞外mRNA的特殊序列,將細胞活性化。
研究團隊此前已揭示具有特定序列的細胞外mRNA通過與免疫細胞表面接受者結合,可增強對癌症轉移抑制能力。
mRNA通常作為基於細胞遺傳資訊合成蛋白質的模板,但在此過程中展現出作為細胞間資訊傳遞介質的全新生理功能。然而,由於mRNA在血液中易被快速分解,所以一直難以應用於藥物。
為此,研究團隊此次合成了具有特殊序列和穩定化化學修飾的50鹼基RNA(s-mRNA)。該物質基於荷瘤小鼠(皮下等部位移植原發癌的小鼠)肺組織中的細胞外mRNA設計。NK細胞和細胞毒性T細胞均表達mRNA接受者。此RNA兼具天然mRNA同等的免疫細胞(NK細胞和細胞毒性T細胞)活性化能力、以及不被血液中RNA分解酶分解的特性。
對小鼠個體給藥後,確認可有效抑制癌細胞的肺轉移。
研究還發現,即使多次給藥也未出現細胞介素風暴等副作用和免疫細胞耗竭現象,且抑制效果持續穩定。
在將大腸癌患者分離的NK細胞、CTL細胞與癌細胞株共同移植至免疫缺陷小鼠的實驗中,施用s-mRNA後同樣確認可抑制癌細胞的肺轉移。
平塚教授表示:「抗轉移藥物是有望從根本上治療癌症的藥物。以國際癌症轉移學會為代表,許多研究學者都在長期致力於相關研究,但此前是利用針對原發癌細胞的藥物來開發抗轉移藥物的。癌症轉移環境與原發癌截然不同,受轉移目標器官的顯著影響,因此需要專門針對轉移的藥物。此次的抗轉移藥物具有轉移獨特性,可實現簡便安全給藥,效果值得期待。我們將繼續推進研發,力爭在不久的將來讓癌症患者受益。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Communications
論文:Synthetic short mRNA prevents metastasis via innate-adaptive immunity
DOI:10.1038/s41467-025-57123-y