東京科學大學研究生院醫齒學綜合研究科分子腫瘤醫學領域的田中真二教授、島田周助教,以及谷合智彥聯合研究員(東京慈惠會醫科大學綜合醫科學研究中心基因療法研究部)等人的研究團隊發表研究成果稱,通過對約700例病例進行單細胞分析,成功將肝癌劃分為不同亞型,並確認血管生成抑制劑與免疫檢查點抑制劑的聯合療法對惡性程度較高的MTM/VECT型肝癌有效。研究團隊在小鼠實驗中也證實了聯合療法的有效性。該成果有望為肝癌治療開闢新路徑。相關成果已發表在美國肝臟學會期刊《Hepatology》的2月26日刊上。
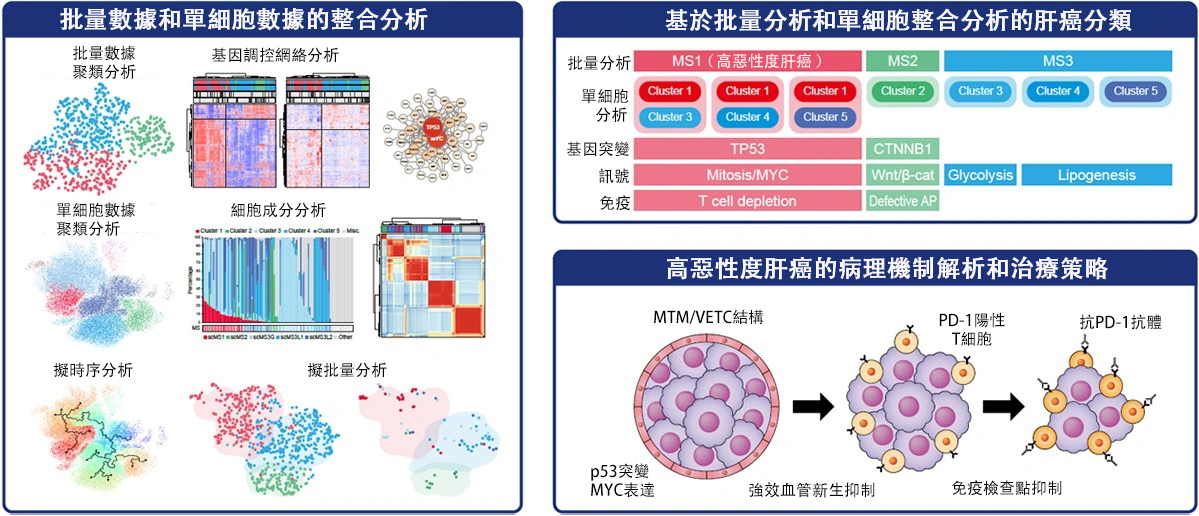
圖1.基於肝癌亞型分析的治療策略(供圖:東京科學大學)
肝癌通常由多種慢性肝病發展而來。復發率高,預後依然較差且個體差異顯著,因此普遍認為需要發展個體化醫療,以實現更有效的治療。
肝癌可分為TP53癌症抑制基因(p53突變)突變較多的「增殖型」與「非增殖型」。具有癌細胞呈10層以上重疊的粗梁型優勢結構(MTM)或腫瘤塊被血管內皮細胞包裹的結構(VECT)、浸潤性和轉移性高的惡性肝癌(MTM/VECT肝癌)佔30%。然而,其分子機制此前一直未被闡明。
此次,研究團隊為精確界定肝癌亞型,對公開數據庫中記錄的691例肝癌樣本進行了全腫瘤細胞分析(批量分析)、並僅針對肝癌細胞進行了單細胞分析(228564個細胞),同時利用超級計算機進行了整合分析。
通過批量分析,研究團隊將肝癌分為此前報導的MS1型(高惡性度)、MS2型(CTNNB1突變)、MS3型(代謝異常)三種類型。通過基因通路分析,明確了p53/MYC異常在MS1型肝癌中起核心作用。
通過對約23萬個細胞進行單細胞分析表明,肝癌細胞可分為簇1(細胞分裂亢進)、簇2(Wnt/β-catenin信號激活)、簇3(糖酵解亢進)、簇4和簇5(脂質合成亢進)這5個主要簇群。進一步通過擬批量分析發現,MS1型由簇1與簇3、4、5組合構成,且確認到T細胞浸潤減少的現象。
對臨床樣本中具有p53/MYC異常的MS1亞型肝癌進行分析後發現,MTM/VECT肝癌較多且T細胞較少,並證實該亞型可通過CT成像進行預測。
研究團隊構建了導入p53缺失和MYC表達的高惡性度小鼠肝癌細胞模型,並將該細胞皮下移植到小鼠體內,再現了MTM/VECT肝癌和T細胞浸潤減少的特徵。移植初期存在T細胞,但皮下移植3~4周後形成MTM/VECT結構,T細胞減少。實驗證實,MTM/VECT結構形成後,免疫檢查點抑制劑無效。
因此,研究團隊將該細胞株移植到正常免疫小鼠體內,並聯合使用血管生成抑制劑(侖伐替尼)和免疫檢查點抑制劑(抗PD-1抗體)後,觀察到腫瘤顯著縮小的效果。血管生成抑制劑可消除MTM/VECT結構,同時確認到腫瘤內T淋巴細胞浸潤增加。研究人員認為,MTM/VECT結構可能像屏障一樣阻礙免疫細胞。
研究表明,在明確亞型的基礎上使用更強效的血管生成抑制劑,或可進一步提高治療效果。
田中教授表示:「今後,我們將分析現有的臨床試驗數據,評估對不同亞型的效果。同時,儘管此次研究聚焦於MS1,但今後還將繼續解析其他亞型,推動開發更合適的治療方法。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Hepatology
論文:Integrative transcriptome profiling elucidates molecular and immunovascular characteristics of macrotrabecular hepatocellular carcinoma
DOI:10.1097/HEP.0000000000001284