日本公益財團法人川崎市產業振興財團奈米醫療創新中心(iCONM)客座研究員宮田完二郎(東京大學研究生院工學系研究科教授)的研究團隊成功開發出了與脂質奈米粒子等現有奈米藥物完全不同的動態奈米機器,通過向前哨淋巴結遞送反義核酸,抑制了乳腺癌的復發和轉移。研究團隊計劃在5年內啟動臨床試驗。相關研究成果已發表在《JACS》上。
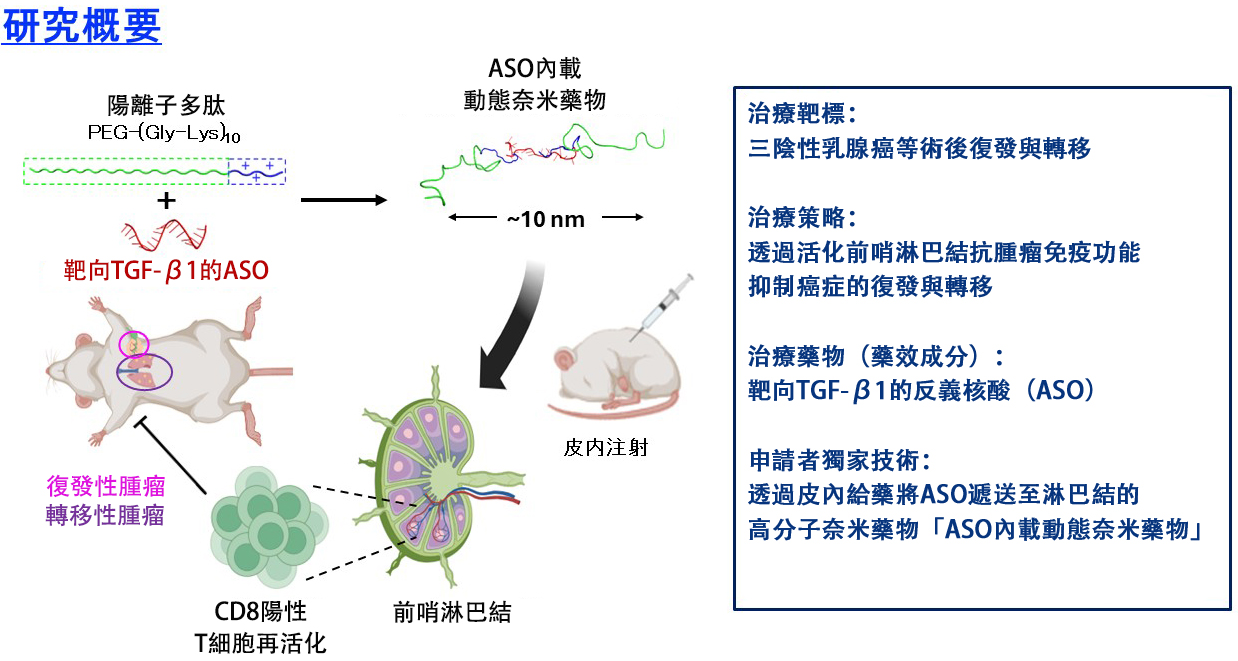
圖1 動態奈米機器實現前哨淋巴結核酸藥物遞送與癌症免疫療法(供圖:東京大學宮田研究室)
前哨淋巴結(SLN)是乳腺癌轉移時的第一道關卡,在阻止癌症進展方面發揮著重要作用。然而,在具有轉移能力的進展期癌症中,SLN內癌細胞等分泌的蛋白質TGF-β1,會使原本應攻擊癌細胞的細胞毒性CD8陽性T細胞失活。
研究團隊旨在通過重新激活該細胞毒性CD8陽性T細胞,來抑制乳腺癌的復發和轉移。研究人員設計了降低TGF-β1表達水平的反義核酸(ASO),並開發出將其遞送至SLN的奈米機器。
一般來說,包括淋巴結在內的生物組織具有精細的網狀結構,因此需要製備能夠通過該結構尺寸的藥物或藥物遞送系統,相比血管系統,淋巴系統藥物遞送難度更高。例如,新型冠狀病毒疫苗中使用的脂質奈米粒子尺寸為100奈米,其尺寸對於向淋巴結遞送藥物可能過大。
針對該課題,研究團隊通過製備10奈米級弱結合包載ASO的動態奈米機器,不僅高效實現SLN的ASO遞送,並使ASO在靶向免疫細胞內發揮作用。
這種奈米機器通過精準調控嵌段共聚體的「帶正電胺基酸序列」與「生物相容性聚合體聚乙二醇(PEG)的鏈長(或分子量)」來實現。研究發現,與10個帶正電的離胺酸連續排列的氨基酸相比,中間插入不帶電荷的甘胺酸、具有10個甘胺酸-離胺酸重複結構的氨基酸,能夠弱結合包載帶負電的ASO,並在靶細胞內適當釋放ASO。此外,通過將PEG分子量調整至1萬左右,能夠增加SLN內的ASO分佈量與分佈範圍,同時減少向其他正常組織的ASO分佈。
實驗結果表明,在小鼠模型中,經過優化的奈米機器能夠減少SLN內的TGF-β1量,重新激活SLN內已耗竭的CD8陽性T細胞,顯著抑制乳腺癌切除手術後的癌症復發和肺轉移。
這些發現為進展期乳腺癌提供了簡單且安全的核酸藥物治療的分子設計指南。研究團隊希望在不久的將來構建出能夠抑制三陰性乳腺癌(TNBC)等現有治療方法效果不佳的難治性乳腺癌的轉移和復發,並實現根治性療法。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Journal of the American Chemical Society
論文:Structurally Dynamic Polyplexes Enhance Sentinel Lymph Node Delivery of Antisense Oligonucleotides to Inhibit Breast Cancer Recurrence and Metastasis
DOI:https://pubs.acs.org/doi/10.1021/jacs.5c04234