日本京都產業大學生命科學部的橫山謙教授、中野敦樹客座研究員等組成的研究團隊,與國立研究開發法人理化學研究所放射光科學研究中心、高輝度光科學研究中心、大阪大學超高電壓電子顯微鏡中心、京都工藝纖維大學開展聯合研究,成功將ATP合成酶嵌入到了「仿生膜囊泡泡」中,並通過冷凍電子顯微鏡捕捉到實際產生氫離子流的狀態。該成果有望應用於藥物靶點膜蛋白的結構解析。相關研究成果已發表在期刊《Science Advances》網路版的10月17日刊上。
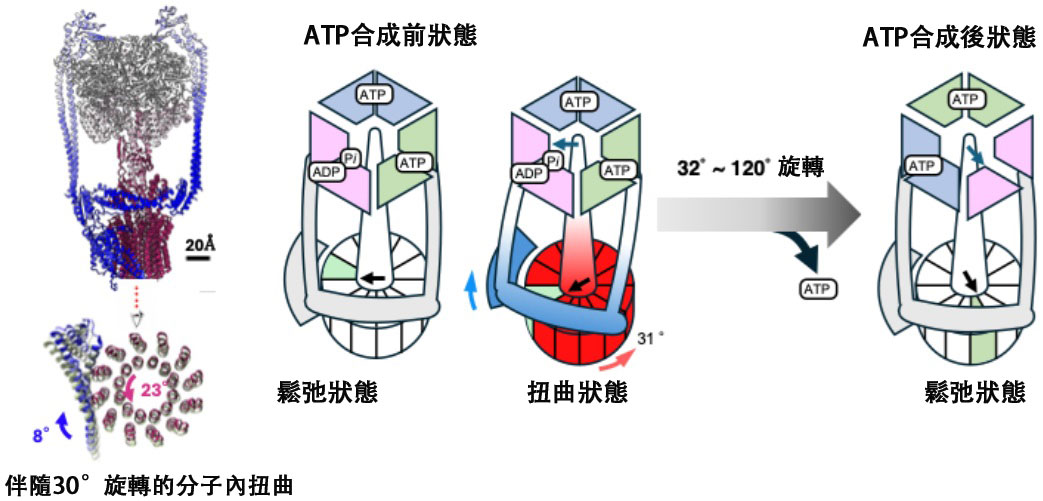
圖 1:基於扭轉作用的ATP合成機制。通過質子驅動力帶動c-ring旋轉,使定子與轉子部分產生分子內扭轉,當積累的分子內扭轉釋放時,會引發含催化位點的膜外部分發生結構變化,進而合成ATP。(供圖:京都產業大學橫山教授)
包裹細胞的生物膜上存在多種膜蛋白,它們承擔著控制營養物質與離子進出及傳遞資訊等功能。多數藥物都以這些膜蛋白為靶點發揮作用。
ATP被稱為生命的能量貨幣,由粒線體膜蛋白——ATP合成酶合成。ATP合成酶具有嵌入膜內部分與突出膜外部分的複雜結構,嵌入膜內部分通過氫離子流(質子驅動力)帶動環狀結構旋轉,並將旋轉傳遞至膜外部分後便可合成ATP。
然而,此前研究無法直接觀察質子驅動力作用過程中的結構,只能對從膜中提取出的狀態進行解析。
對此,此次研究團隊為捕捉ATP合成酶的動態瞬間,將細菌來源的ATP合成酶與可利用發光能量運輸氫離子的膜蛋白「細菌視紫紅質」,共同嵌入人工製備的仿生膜囊泡泡(微脂體)。當在光照條件下,細菌視紫紅質會將氫離子運輸至囊泡內,形成質子驅動力。如果在此時加入ATP的材料物質ADP和磷酸,便會啟動ATP合成酶介導的ATP合成反應。
通過冷凍電子顯微鏡觀察確認,無質子驅動力時,ATP合成酶的催化位點上可檢測到ADP;存在質子驅動力時,催化位點上可檢測到ATP,研究人員成功捕捉到酶實際合成ATP時的結構。
此外,研究人員還確認到膜內環狀部分(c-ring)發生約30度旋轉的結構,且膜內部分與膜外部分之間產生了「扭轉」。研究認為,旋轉運動轉化為「分子內扭轉」,正是這一作用力推動了ATP合成反應的進行。
多數藥物的靶點膜蛋白嵌入生物膜中,通過生物膜兩側的質子驅動力以及離子濃度差所形成的膜電位來發揮作用。該技術有望為更高效的藥物設計提供支持。
橫山教授表示:「生物膜上有由離子濃度差形成的膜電位,多數膜蛋白藉此實現功能。此次研究將ATP合成酶嵌入微脂體,成功確定了膜電位存在下的結構。該方法可應用於藥物靶點膜蛋白的研究,膜電位條件下的結構資訊將為新藥研發提供新視角。本研究不僅有助於深化對ATP合成酶的理解,還有望推動膜蛋白研究與新藥研發。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Science Advances
論文:Structures of rotary ATP synthase from Thermus thermophilus
during proton powered ATP synthesis
DOI:10.1126/sciadv.adx8771