在細胞內即時激活目標蛋白質,自由地調控細胞功能——如果存在此類技術,便可選擇性地清除癌細胞或激活特定細胞。這是實現無身體負擔治療的一項重要技術。近年來,通過外部光照調控蛋白質活性的光遺傳學方法備受關注,但該方法存在難以抵達生物組織深部的難題。
日本金澤大學奈米生命科學研究所的新井敏教授等人組成的研究團隊,利用比光更易抵達深部的熱量,成功開發出一種以溫度變化為「開關」即時激活目標蛋白功能的分子工具。研究團隊合成了一種蛋白質,融合了引發細胞死亡(該細胞死亡能更好地維持生物體狀態)的「凋亡」酶:「半胱天冬酶8(CASP8)」,以及具有隨溫度升高產生凝集性質的「彈性蛋白樣多肽(ELP)」。研究團隊利用這種蛋白質在超過某一特定溫度後會局部濃縮並激活CASP8的特性,實現了CASP8在正常體溫下不發揮功能,加熱後發揮功能並「開啟」程式性細胞死亡的機制。研究人員還進一步使用該蛋白質,通過近紅外光雷射對單個目標細胞進行局部加熱,成功實現了程式性細胞死亡的選擇性誘導。
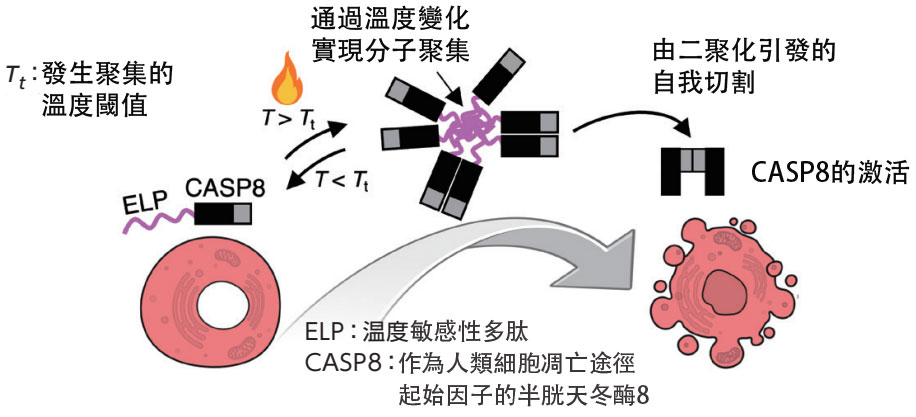
利用超過某一溫度後有聚集性質的ELP與誘導凋亡的CASP8相融合的蛋白質,以溫度變化作為「開關」來誘導程式性細胞死亡。
本次開發的分子工具,通過在相對於溫度變化無大幅功能變化的蛋白質上加入溫度響應結構域,實現了根據溫度變化的「開啟和關閉」功能。該技術不僅適用於醫療應用,預計還將在廣泛的生物領域發揮作用。(TEXT:中條將典)
原文:JSTnews 2025年11月號
翻譯:JST客觀日本編輯部