[上篇]
大阪市TPC市場調研公司於2018年11月30日發布的最新調查報告顯示,2017財年度日本再生醫療相關產品和服務的市場規模,較上一年增加20.0%,到390億日元。市場增長的一個關鍵因素是,新藥研發和既有藥物新適應症拓展過程中對關聯消耗品、生產設備、運輸服務等周邊產業的需求增大。
2018年以來市場規模繼續保持擴大態勢,預計2020年將達到660億日元,2030年到3600億日元規模。尤其是iPS細胞研究十年來,成果漸漸隱現,近期頻頻走進臨床。器官移植、慢性病等領域的細胞治療產品上市明顯加速。與此同時,對研發、生產用儀器,以及合同外包研發(Contract Research Organization, CRO)和生產(Contract Manufacturing Organization, CMO)等服務的需求預計也將迅速增長。
2013年以後,化藥製造商等外部企業也都紛紛進入再生醫療領域。隨著再生醫療和細胞治療市場的逐步擴大,國家和地方政府也正在積極加強對再生醫療研究開發和初創企業等的支持力度。
下面我們來詳細瞭解一下日本對於再生醫療和細胞治療領域的監管機構及相關法律法規。
日本再生醫療領域的主要國家監管部委為:厚生勞動省、經濟產業省、文部科學省、醫藥品醫療器械綜合機構(PMDA)。四個機關單位在研究推動、設計開發、許可認定、品質評價、程序審查等具體事務上各有側重和分工協作,另外日本規格協會(JSA)負責安全性評價等行業標準制定(圖1)。
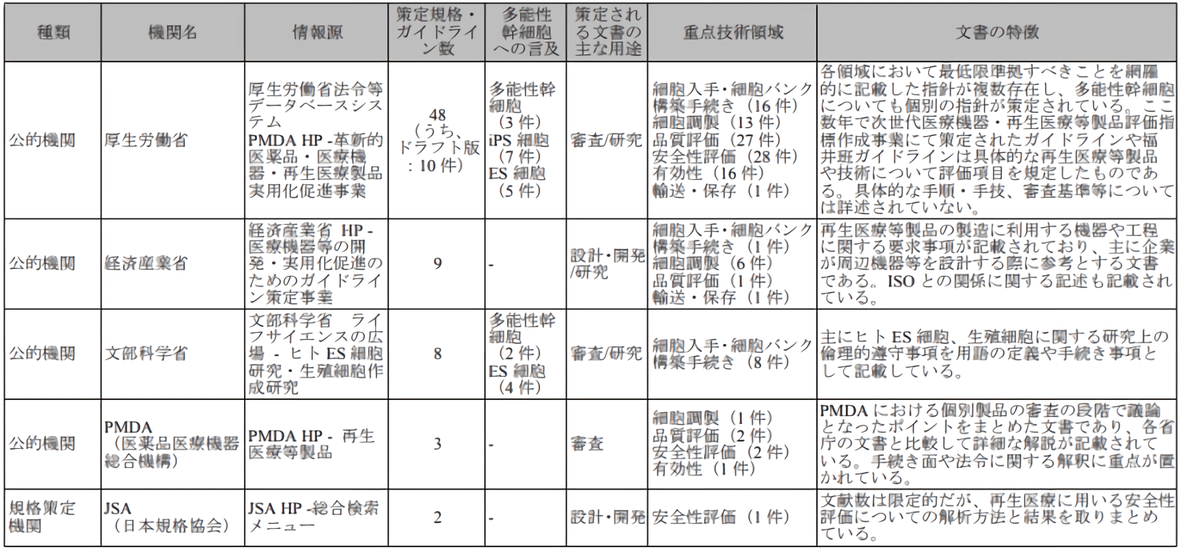
圖1 日本再生醫療主要監管部門 [出處:參考文獻1]
再生醫療創新論壇(FIRM)、日本再生醫療學會、京都大學iPS細胞研究所(CiRA)等主要相關機構也在細胞採集、製備、運輸、保存等具體技術層面上都制定了業内指導文件(圖2)。
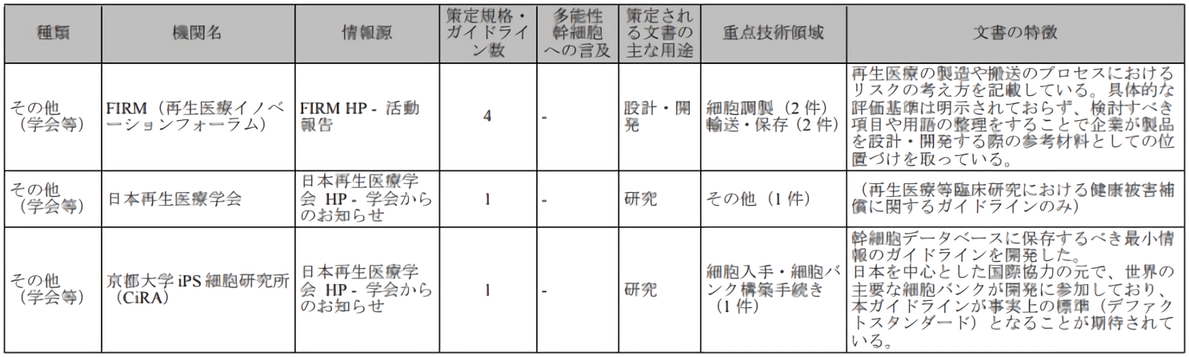
圖2 日本再生醫療主要協會機構 [出處:參考文獻1]
2010年以來,經濟產業省主要對細胞培養相關設備及工藝流程等方面制定了一些指導方針。近年,厚生勞動省主導制定的法規較多,針對不同的疾病領域、細胞類型等都分門別類地做了詳細規定,也是評估審查的主要參照標準(圖3)。
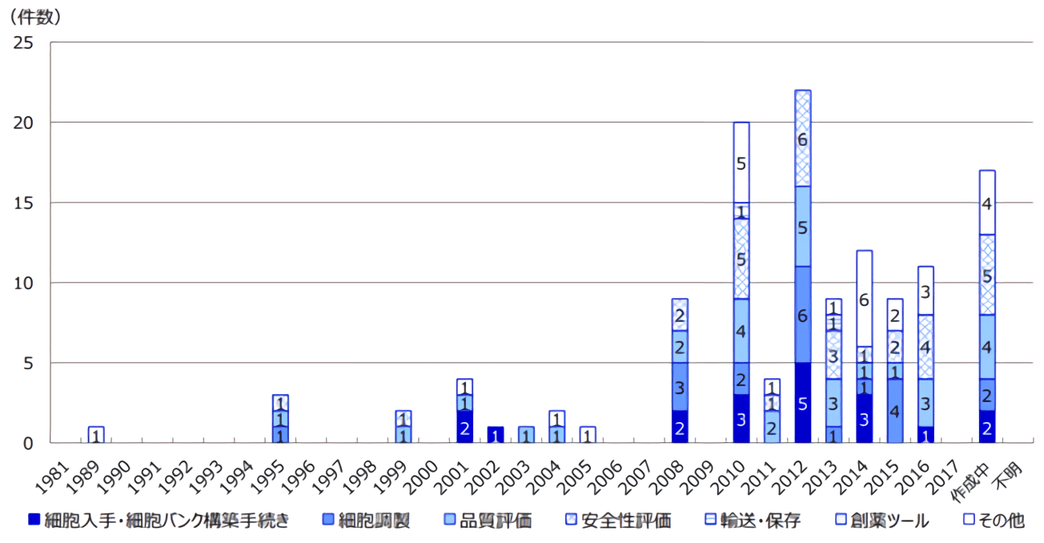
圖3 日本再生醫療領域相關法規實施年代表 (圖出處:三菱綜合研究所)
2014年11月,《再生醫療安全確保法》、《醫藥品和醫療器械品質、有效性及安全性確保法》(《藥械法》)等新的法律框架正式實施以來,再生醫療臨床和上市審批週期都大大加快(圖4),更多的企業和研究機構進入再生醫療領域,研究成果湧現,臨床試驗數量激增,再生醫療產業進入活躍期[1]。
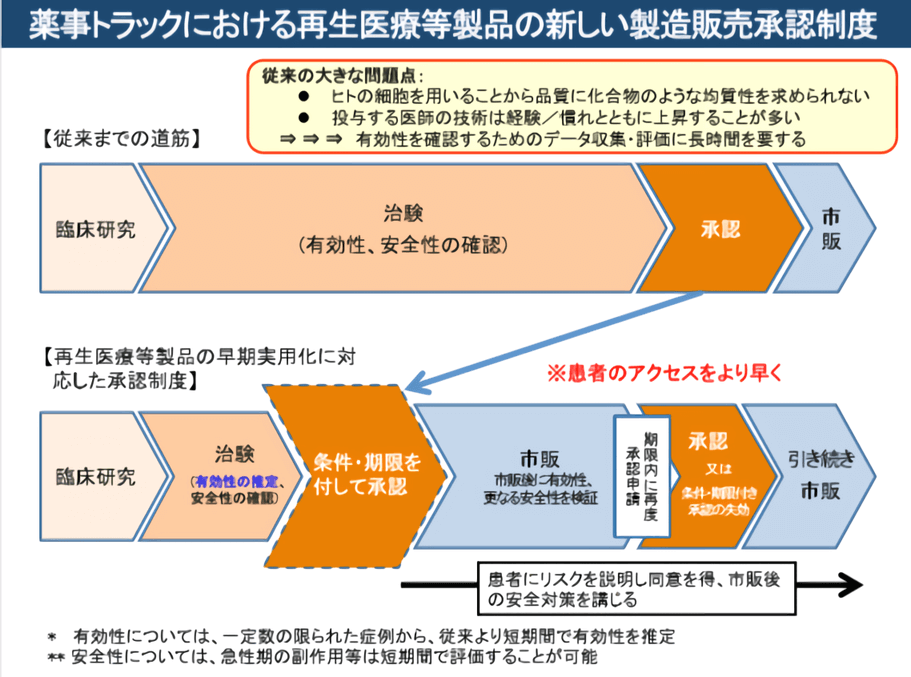
圖4 日本新法規下藥品審批流程加快 (圖出處:佐藤陽治/NIHS)
根據不同細胞療法對患者帶來的潛在風險不同,審批程序也不一樣(圖5)。比如通過體外活化自體淋巴細胞回輸的常規LAK或ANK免疫細胞療法歸為低風險的第三類再生醫療;用自體脂肪衍生幹細胞豐胸等屬於中度風險的第二類再生醫療;而進行體外基因操作後再回輸的CAR-T療法列為風險最高的第一類再生醫療。
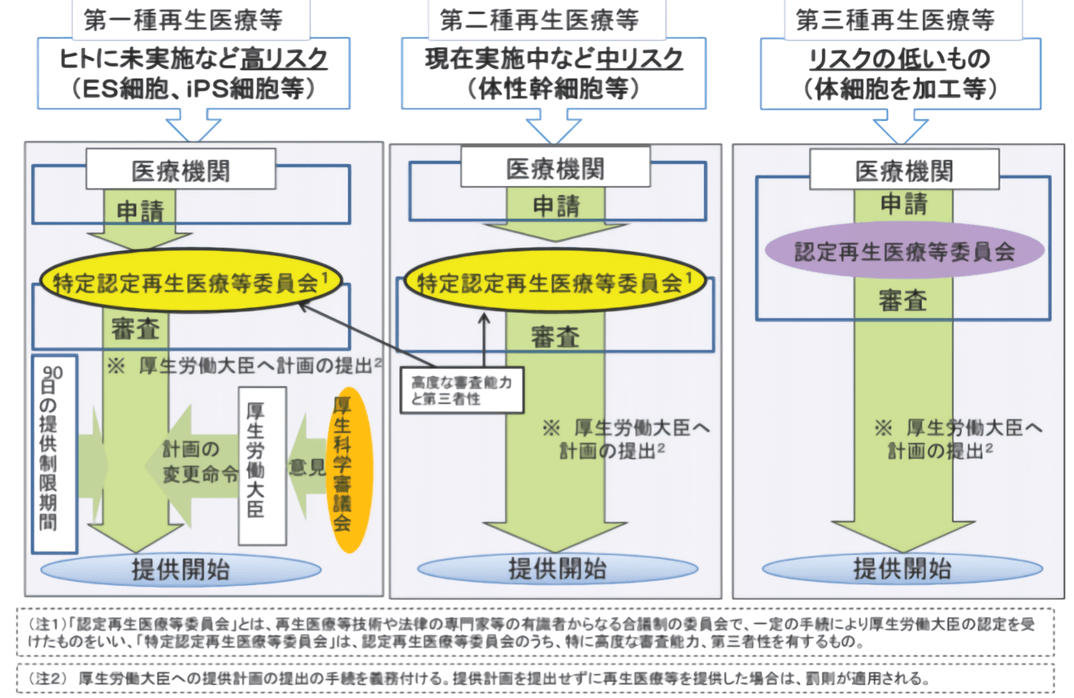
圖5 再生醫療風險等級分類 (圖出處:佐藤陽治/NIHS)
整體來講,僅是在診所或醫院等機構内部實施的免疫細胞採集和治療,以及研究者發起的臨床試驗,屬於《再生醫療安全確保法》的管轄範疇。如果有第三方企業等介入免疫細胞的基因操作、加工製備、生產銷售等,則涉及《藥械法》(修訂後的《藥事法》)(圖6)。
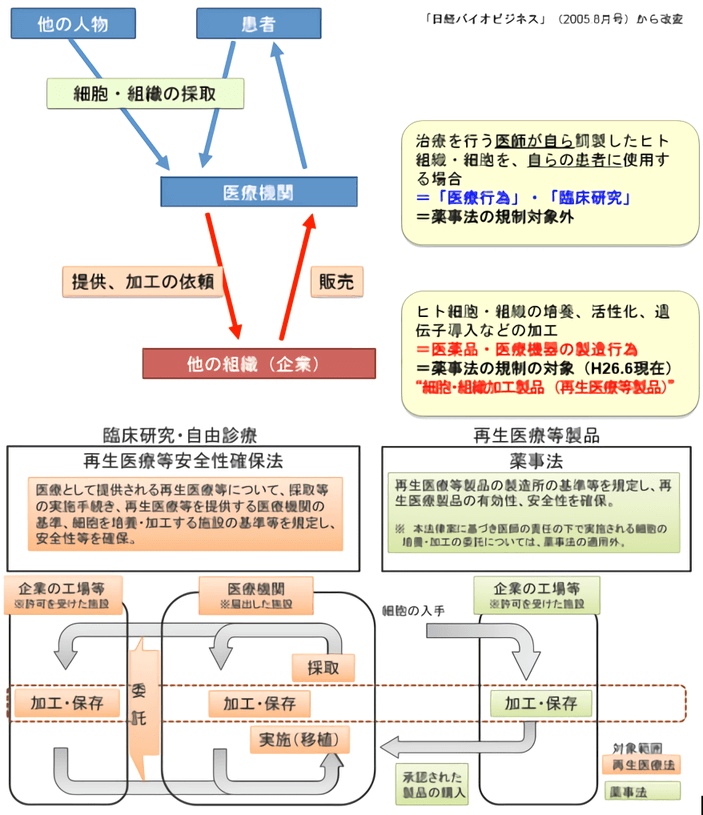
圖6 新法規下的再生醫療監管 (圖:佐藤陽治/NIHS)
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
參考文獻:
1.「再生醫療に関する標準化動向調査」報告書, 2017月3月, 株式會社三菱総合研究所
相關鏈結:
1.厚生勞動省再生醫療相關法規 [網路位址]













