長崎大學熱帶醫學研究所分子感染動力學解析領域的稻岡健Daniel教授、愛媛大學蛋白質科學中心的福本隼平特定研究員、群馬大學研究生院保健學研究科的德舛富由樹教授的研究團隊,與日本國立國際醫療研究中心研究所、自治醫科大學合作,於2月14日發表研究成果稱,發現了瘧原蟲生存所必需的脂質合成酶——醯基轉移酶(PfLPLAT1)。當破壞該酶的基因後,瘧原蟲就會迅速死亡。該成果有望為開發新的抗瘧疾藥物做出貢獻。相關成果已發表在國際學術期刊《Communications Biology》的1月29日刊上。
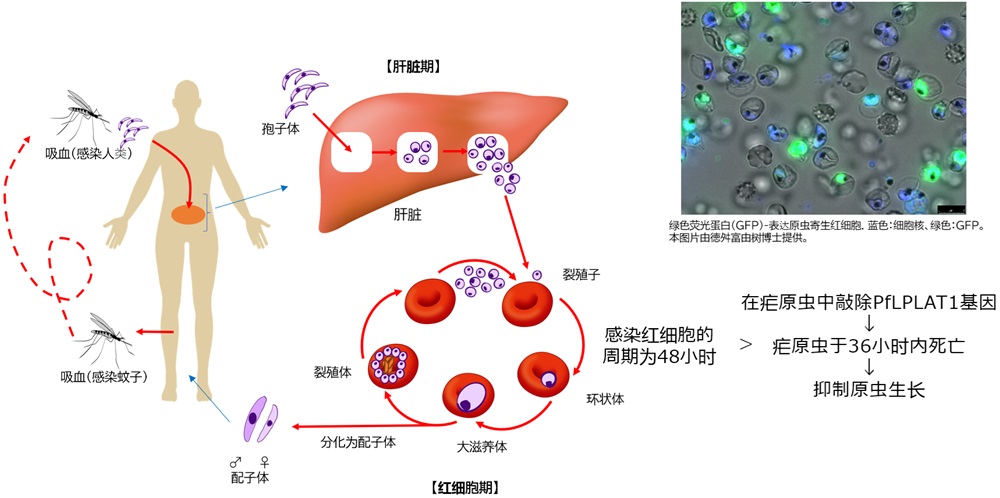
圖1:瘧原蟲的生物週期和醯基轉移酶(PfLPLAT1)基因受破壞株影響的效果。本圖修改自 「Development of Medicines for Infectious Diseases-Malaria」, K. Kita, Yakugakuzasshi, 140(7): 888, (S. Matsui 和 J. Hong)(供圖:長崎大學)
瘧疾是世界三大傳染病之一,每年約有2.6億人感染並造成60萬人死亡,主要流行於非洲和東南亞地區。引發瘧疾的瘧原蟲通過蚊蟲叮咬進入人體,首先在肝臟中增殖,然後侵入紅血球並增殖,繼而引發高熱、貧血等症狀。惡性瘧原蟲感染更可能導致腦傷、酸中毒(血液過度加酸)及重症貧血等致命風險。
現在雖有疫苗,但效果有限且難以普及,目前主要採用被稱為特殊藥物的青蒿素複方療法。然而,已有報告稱出現了青蒿素抗藥性瘧原蟲。
此次,研究團隊重點關注了構成惡性瘧原蟲細胞膜的脂質的合成途徑。瘧原蟲在分裂、增殖時會合成大量脂質,但對這一途徑的研究長期滯後,對該途徑內的酶群也瞭解甚少。
研究人員在磷脂質合成途徑中,針對在僅含單一醯基鏈(磷脂分子中的脂肪酸衍生雙碳鏈)的磷脂質上再添加一條醯基鏈並轉化為常規磷脂質的「溶血磷脂醯基轉移酶」進行了鑑定與泛函分析。此前有報導稱這種酶在細胞水平上具有活性,但酶本身的功能從未得到證實。
因此,研究團隊從基因數據庫中篩選出與人類酶相似的功能未知的基因(PfLPLAT1),製作出能夠進行條件獨特性基因破壞的基因改造瘧原蟲,並對該酶的功能進行了分析。
結果顯示,當該基因遭破壞時,瘧原蟲在大約36小時內死亡,比其感染紅血球的48小時週期還要短。另一方面,在破壞基因的同時強製表達PfLPLAT1時,瘧原蟲就不會死亡,這表明PfLPLAT1酶對瘧原蟲的生存不可或缺。在瀕死的瘧原蟲細胞中,觀察到了明顯的結構缺陷。
對酶活性進行研究後發現,這種酶具有將多種溶血磷脂轉化為二醯基體的功能,並且明確了它是維持生物膜中多種分子構成比例的分子。
脂質合成途徑不僅涉及細胞內的代謝,還能生產構成細胞膜的分子,因此有望為同時破壞代謝和結構的藥物開發帶來新的突破。
稻岡教授表示:「此次研究最大的突破在於證實PfLPLAT基因對瘧原蟲的生存不可或缺。由於該基因不可或缺,使用常規的基因破壞方法無法獲得存活的瘧原蟲,最終通過添加雷帕黴素建立基因破壞系統才得以解析,此過程最為艱辛。論文的責任作者德舛博士(群馬大學)是瘧原蟲脂質代謝領域的權威專家。期待未來開發以PfLPLAT為靶點的新藥,並進一步明確PfLPLAT在瘧原蟲的生物週期以及對寄主環境的適應等生命現象中如何發揮作用。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Communications Biology
論文:Pivotal roles of Plasmodium falciparum lysophospholipid acyltransferase 1 in cell cycle progression and cytostome internalization
DOI:10.1038/s42003-025-07564-4