日本北陸先端科學技術大學院大學物質化學前緣研究領域的都英次郎教授的研究團隊,通過與第一三共株式會社、筑波大學生命環境系的高谷直樹教授等人的共同研究,成功開發出兩種細菌會緊密配合,選擇性攻擊癌細胞的新型細菌療法「AUN(阿吽)」。鑒於該療法在免疫缺陷小鼠體內移植的人類癌症(肉瘤、轉移性肺癌、抗癌藥物耐受三陰性乳腺癌TNBC等)中展現出了100%的有效性與120天內的100%生存率,加之安全性也已得到確認,都教授表示:「希望在2028年之前於美國創立初創公司,並在6年以內啟動Ⅰ期臨床試驗。」相關研究成果已發表在期刊《Nature Biomedical Engineering》上。
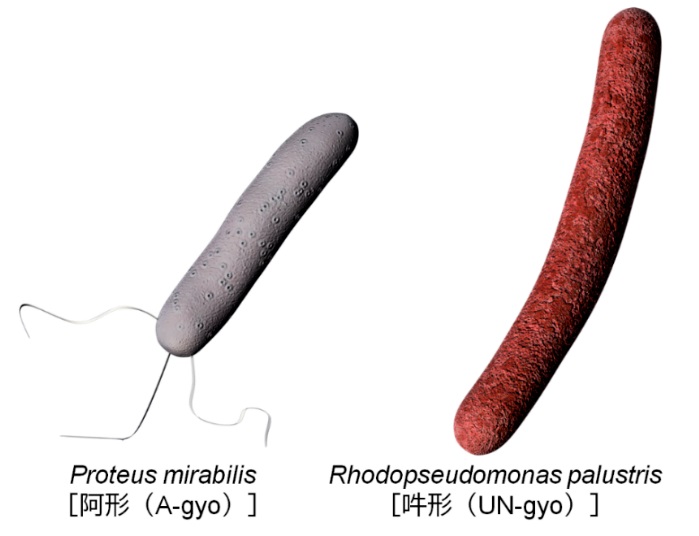
圖1 AUN的兩種細菌(A-gyo與UN-gyo)(供圖:北陸先端科學技術大學院大學都英次郎教授)
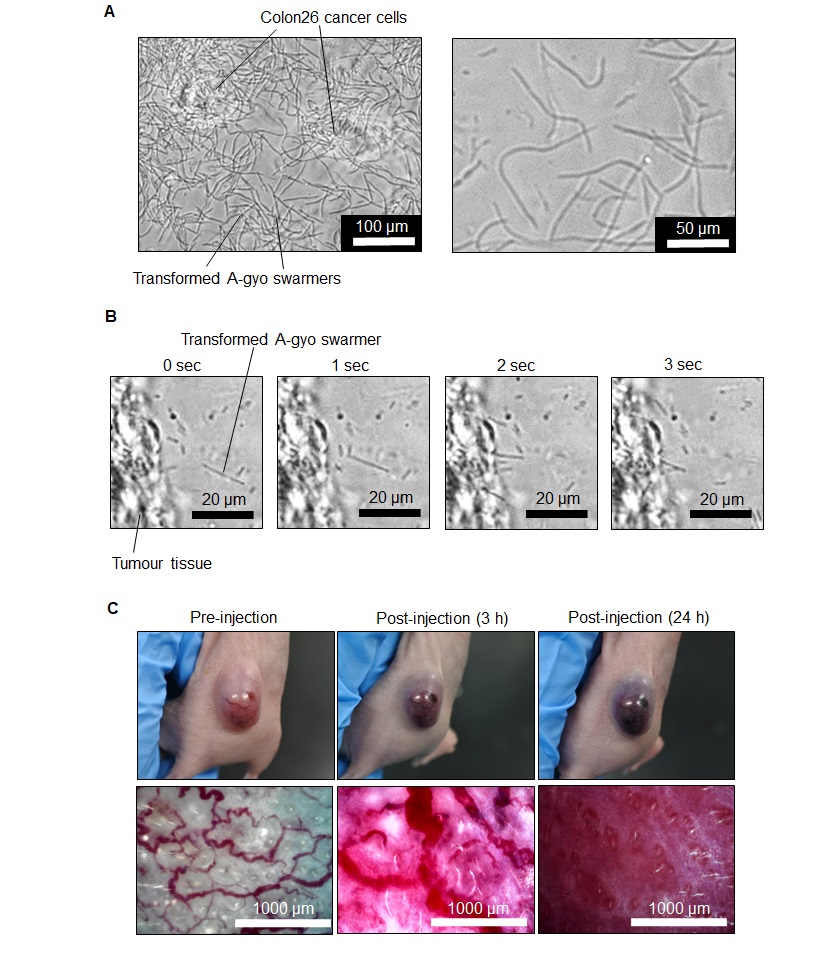
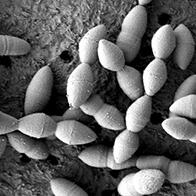
圖2 A-gyo細菌驚人的變形以及宛如瞄準癌症的「活長槍」攻擊(供圖:北陸先端科學技術大學院大學都英次郎教授)
(A)形態變化的顯微鏡圖像:與小鼠來源大腸癌細胞(Colon26)共培養24小時後,A-gyo完成了從通常的短桿菌形態向宛如蛇一般細長延伸的「游動細胞」的劇烈變化。該變化即使在肉眼觀察下也很明顯,在低倍率(左)下便能觀察到其形態,在高倍率(右)下則能清晰確認纖維狀結構的細節。
(B)A-gyo在癌組織內的活動:通過即時觀察,捕捉到了具有往返移動性的A-gyo游動細胞像穿透癌細胞一樣刺入癌組織的情景。其精準瞄準目標的姿態,儼然是一柄「活長槍」。
(C)以癌血管為目標的破壞瞬間:向小鼠癌症模型靜脈注射AUN細菌後,幾小時內癌組織內的血管網會迅速被破壞,流向腫瘤的血液被阻斷。這一「血管阻斷效應」會使癌組織壞死,腫瘤迅速縮小。
細菌療法在日本的認知度偏低,但在歐美其研究正穩步推進。該療法使用的是厭氧菌,具有容易向低氧狀態下的癌細胞聚集的特性,但由於普通厭氧菌的藥效較低,目前會使用經過基因改造的沙門氏菌、李斯特菌、大腸桿菌等細菌,故而安全性受到質疑。
AUN所使用的是腫瘤內常駐的奇異變形桿菌(Proteus mirabilis)[阿形(A-gyo)],和存在於河流等環境中的光合細菌沼澤紅假單胞菌(Rhodopseudomonas palustris)[吽形(UN-gyo)]這兩種天然細菌。研究團隊此前曾致力於使用紫色非硫細菌開發癌症的光診斷與光治療技術,在這一過程中,他們發現了向患癌小鼠施用紫色非硫細菌後腫瘤表面會發光,照射近紅外光線時細菌會攻擊癌細胞的現象。
在這項研究的過程中,研究團隊發現通過將阿形與吽形組合使用,可獲得針對腫瘤的較強攻擊性,並於2023年發表了該組合對小鼠癌症具有顯著效果的結論。
然而,阿形與吽形組合是否對非小鼠來源的癌症也有效果?尤其是人類來源的癌症僅能在免疫缺陷狀態的動物體內定植和增殖,因此,在免疫缺陷的環境下是否仍會發揮效果,此前尚不明確。
研究團隊向移植了人胰腺癌的局部性胰腺癌模型小鼠施用AUN6天後,癌細胞即完全消亡。此外,在廣泛敲除免疫系統的超免疫缺陷人源化小鼠中移植的人大腸癌中,癌組織也在第5天完全消亡。
其作用機制極為獨特。阿形與吽形細菌以3:97的比例共生時處於穩定狀態,但當二者在癌細胞周圍聚集後,僅有阿形會侵入癌細胞內部。阿形會在癌細胞內反復增殖,6小時後佔比上升至20%左右,並分泌屬於細胞分解素的毒素、溶血素、磷脂酶和腺苷酸環化酵素,引發癌細胞的選擇性裂解。研究團隊實際觀察到了腫瘤變色及腫瘤內部血管的破裂現象。在此期間,還觀察到阿形在癌細胞代謝產物的作用下發生變形,變為類似長槍的形態並獲得運動能力,反復多次刺入癌細胞的情景。
對阿形的基因進行分析後發現,其缺失了與致病性因子——黏著素和纖毛相關的基因。據悉,阿形與吽形均被歸為生物安全等級1,無致病性,且可通過抗生素輕鬆清除。
都教授表示:「以往的癌症免疫療法是以具備自體免疫力為前提的。而AUN能夠動態、物理性地攻擊並清除癌細胞,因此即使在免疫缺陷狀態下也能發揮顯著效果。阿形與吽形可通過共培養獲得顯著效果,堪稱天衣無縫般的‘阿吽之息’。在美國開展的臨床試驗中,將以傳統治療方法無效的患者作為治療對象,通過持續產出結果,逐步擴大該療法的適應範圍。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Biomedical Engineering
論文:Tumour-resident oncolytic bacteria trigger potent anticancer effects through selective intratumoural thrombosis and necrosis
DOI:10.1038/s41551-025-01459-9